4.2 细胞周期的调节
对于生物来说,没有什么比DNA的准确复制和正确的细胞分裂更重要的了。如果出问题会引起细胞功能异常,或者是疾病,例如癌症。真核细胞进化出一套复杂的系统调节细胞分裂,保证DNA的准确复制。这些调节主要是各种各样的“检查点”,这些“检查点”判断是否进行下一步。如果调节系统功能正常并探测到DNA错误,染色体压缩以及细胞分裂就会停止,直到DNA错误被修复。这些检查点调节使得DNA复制暂停的现象通常叫做分子闸(molecular brakes)。
本节我们简要讨论细胞周期调节的分子机制,这个过程通常被称作细胞周期控制系统。我们按照细胞周期的顺序逐个讨论调节方式,从细胞外的触发细胞周期的信号,到胞质分裂期子细胞的分离。
S-细胞周期蛋白和细胞周期蛋白依赖性激酶触发DNA复制
一种叫做细胞周期蛋白的核蛋白质表达触发了DNA复制。胞外信号通过一些因子(例如生长激素)通过诱导核分裂信号蛋白的合成从而触发细胞周期。核分裂信号蛋白的种类随着胞外分裂信号的不同而不同。因此会有许多不同类型的S-周期蛋白会被表达。核分裂蛋白附着到一个启动子区域,DNA中的这个区域能够“打开”基因,从而诱导S-周期蛋白的表达(图4.4)。S-细胞周期附着到一个周期蛋白依赖激酶(Cdk)上面,这是一种论磷酸化酶,它一直存在于细胞核中。周期蛋白-Cdk复合体催化其它蛋白质的磷酸化,从而进入S期并启动DNA复制。蛋白质的磷酸化作为细胞信号的方式在真核生物中很常见。例如,在蠕虫中发现的信号通路,这是第一个发现的生殖关联到寿命的生化机制,下一章详细讨论。
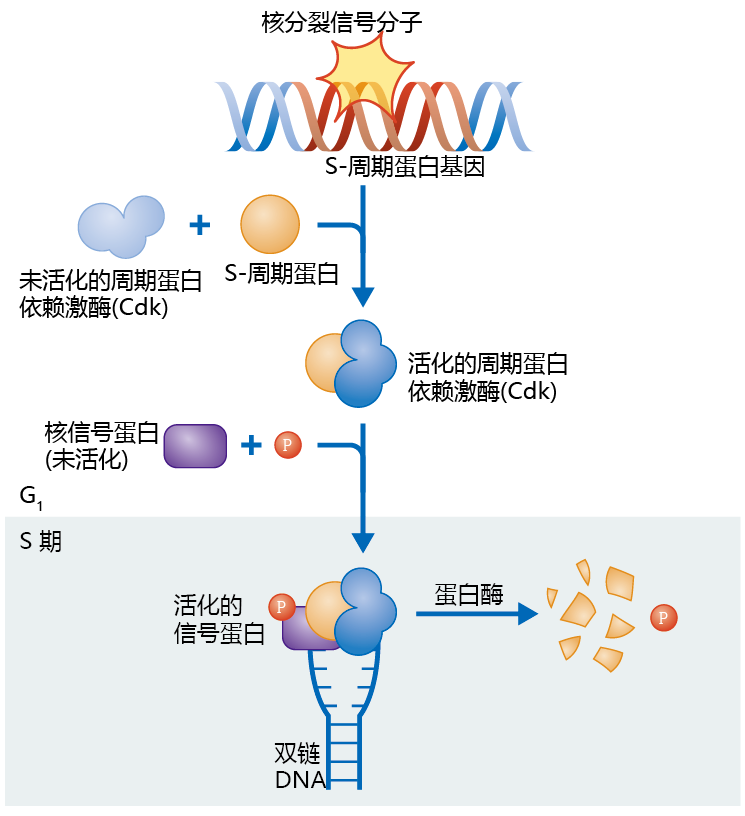
图4.4 周期蛋白触发DNA复制。胞外分裂信号附着到细胞,由此产生一个核分裂信号,从而诱导S-细胞周期的表达。S-细胞周期附着到周期蛋白依赖激酶(Cdk)激活这个酶并且引起其它蛋白质的磷酸化,从而促使细胞进入S期并启动DNA复制。一旦DNA复制开始,Cdk就被降解而失活。
一旦细胞进入S期,DNA的复制会刺激胞内蛋白酶的表达,蛋白酶分离周期蛋白和Ckd的复合体并将周期蛋白降解。最后一步保证在一个细胞周期中DNA只复制一次。
p53蛋白能将DNA复制阻止于G1和S期之间
与细胞周期的其他阶段一样,也有检查点来确保DNA在合成过程中被准确复制。p53通路就是这样一个检查点,它有助于防止受损的DNA被复制。例如,假设由于自由基的攻击,DNA的一部分发生了损伤(本章后面将解释自由基)。DNA修复机制检测错误,开始修复错误部分,并激活一个蛋白激酶用来磷酸化核蛋白p53。活化的p53使其与另一种蛋白质p21的基因启动子区域结合。p21蛋白通过负抑制使细胞周期蛋白Cdk复合物失活,并暂时停止细胞周期(图4.5)。修复完成后,蛋白酶被激活,将p21与细胞周期蛋白Cdk复合物分离,细胞周期进入S期。p53通路通过与端粒缩短的相互作用在细胞衰老中发挥作用(见下文)。
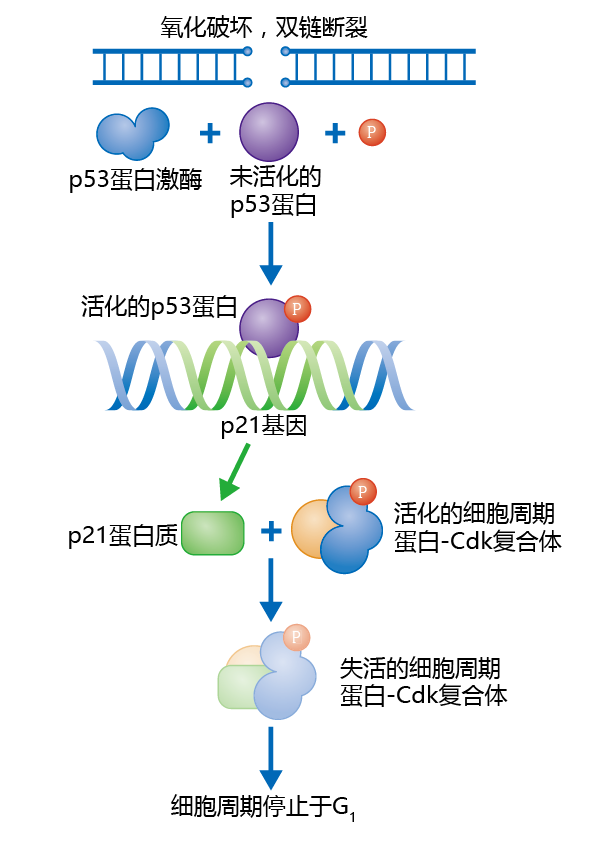
图4.5 G1期的p53检查点。当DNA的破坏被探测到时,例如超氧自由基的破坏(•O2−),修复机制活化p53蛋白激酶。磷酸化的p53蛋白附着到p21基因的调节区域,刺激p21基因的表达。然后p21蛋白结合到周期蛋白-Cdk复合体,使之失活并临时将细胞周期停止在G1期。一旦DNA被修复,蛋白酶降解p21蛋白,细胞进入S期。
许多蛋白质参与DNA的复制
一旦DNA准确性检查完成,细胞周期蛋白Cdk复合物被激活,DNA的复制就可以开始了。DNA复制机制包含几种蛋白质,它们以特定的顺序复制染色体(图4.6A)。其中一种叫做解旋酶的蛋白质利用三磷酸腺苷(ATP)水解释放的能量将DNA分离成单链,用作DNA复制的模板。单链结合蛋白(SSB)将两条链保持分离。另一种蛋白质primase合成启动复制过程所需的短序列RNA(引物)。解旋酶和primase组成了一个称为引发体(primosome)的复制复合体。当DNA链被分离并用RNA启动后,DNA聚合酶通过向模板链的3′端添加脱氧核糖核苷酸开始合成新的DNA。新链的合成总是发生在5′→3′方向,这是DNA聚合酶移动的唯一方式。
DNA复制从复制起始点向两个方向移动。因此,引发体产生的DNA单链模板在5′到3′方向和3′到5′方向都有起始(图4.6A)。5′到3′的方向称为前导链模板,3′到5′的方向称为滞后链模板。由于DNA聚合酶只将脱氧核糖核苷酸添加到生长DNA链的3′端(在母链上沿5′到3′方向移动),因此合成新的前导链相对简单。然而,DNA聚合酶如何从3′到5′方向的滞后链复制新链?聚合酶通过向后移动5′→3′方向来解决这个问题(图4.6B)。当DNA聚合酶向后移动时,它产生称为冈崎片段的小DNA片段(图4.6C)。这个过程需要重复的RNA引物。冈崎片段随后通过DNA连接酶连接在一起(去掉引物然后补充相应的脱氧核糖核苷酸),形成一条连续的链。
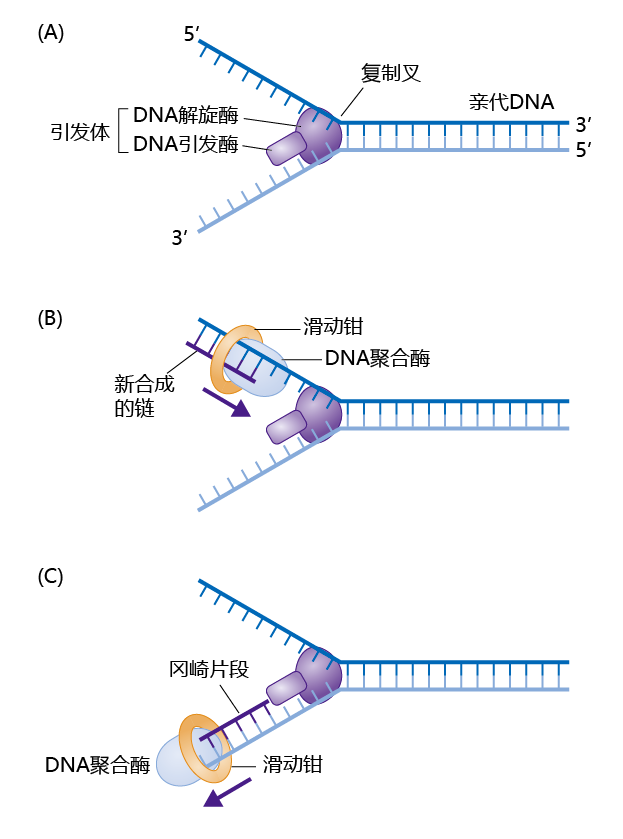
图4.6 DNA复制。(A)解旋酶将双链DNA分离成单链。DNA引发酶合成复制开始所需的RNA引物。 (B)在前导链模板上,DNA聚合酶在5′→3′方向上合成新链,此过程只需要一个引物即可。(C)在滞后链上,DNA聚合酶向相反方向移动,合成小的DNA片段,称作冈崎片段。冈崎片段被“倒缝”在母链上。滑动钳将DNA聚合酶卡在母链上,让它只能顺着模板链移动。
黏结蛋白(cohesin)和凝缩蛋白(condensin)有助于控制染色体分离
在S期结束时,两条被称为姐妹染色单体的新染色体被称为黏结蛋白的蛋白质紧密结合在一起(图4.7)。然而,姐妹染色单体较大且相对无组织,这是一种抑制有效分离的物理条件。被称为凝缩蛋白的蛋白质在G2期组装,并在M期使用,以减小姐妹染色单体的大小并增强链分离过程。另一个对染色体的正确分离很重要的复合体是着丝粒(centromere)。着丝粒将两个染色单体固定在一起,是动粒(kinetochore)形成的部位,动粒将着丝粒连接到有丝分裂纺锤体的结构。
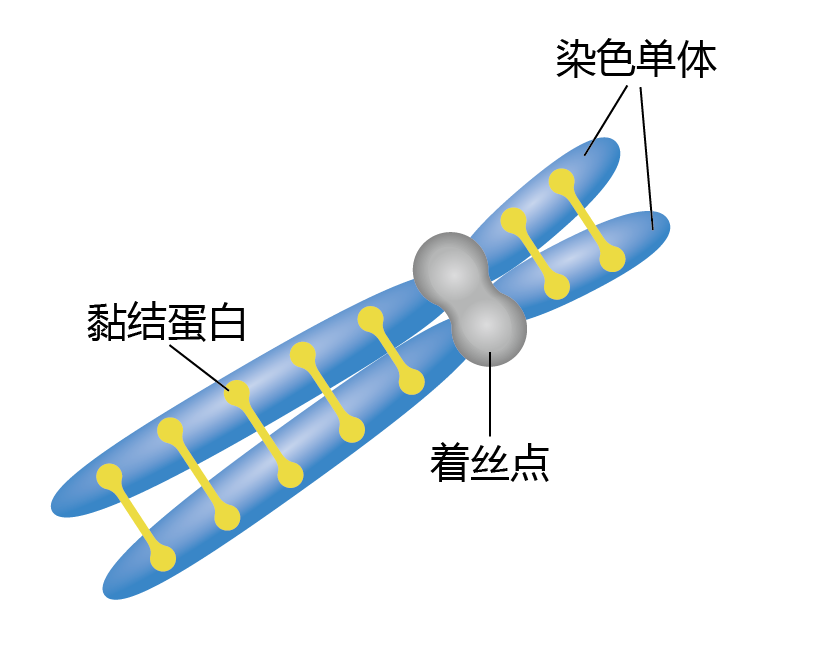
图4.7 在S期复制的姐妹染色单体。着丝点将两条姐妹染色单体绑定在一起。黏结蛋白也参与此过程。
中期到后期的转变标志着细胞周期的最后一个检查点
通过细胞周期蛋白-Cdk复合物调节G2期和M期之间的转换。该过程类似于图4.4中所述的过程;然而,这里表达的是M细胞周期蛋白而不是S细胞周期蛋白。一旦这个细胞周期控制点通过,M期便开始了,细胞周期的最后调节步骤发生在中期到后期的过渡期。细胞周期蛋白-Cdk复合物使用磷酸化-去磷酸化调节系统,而中期到后期的转变涉及蛋白水解过程。这个过程的主要蛋白质是后期促进复合物(APC),它是泛素连接酶家族的一员。这个家族中的许多酶参与标记折叠不当的蛋白质进行破坏的反应。正如你在第9章中了解到的,泛素连接酶可能在阿尔茨海默病和帕金森病的发展中起着重要作用。
APC标志着紧固蛋白(securin)的破坏,该蛋白与连接姐妹染色单体的黏结蛋白结合。紧固蛋白可防止蛋白酶在中期前分解姐妹染色单体。从黏结蛋白中去除紧固蛋白可以使细胞中存在的蛋白酶分离姐妹染色单体。反过来,有丝分裂纺锤体开始向中心体收缩,独立的染色单体开始分离。APC还标记任何剩余的细胞周期蛋白用于降解,再次确保DNA复制只发生一次。细胞周期现在通过终末期和胞质分裂不受阻碍地进行,产生两个新的、相同的细胞。
功能齐全的细胞可以在G0期退出细胞周期
在多细胞生物中,细胞周期的启动似乎只有在细胞接收到来自被称为有丝分裂原(mitogen)的物质的细胞外信号时才会发生。有丝分裂原有多种形式,包括激素、神经肽和类固醇,它们或者产生于远处的细胞,或者作为邻近细胞分泌的因子。如果一个细胞没有在正确的时间接收到有丝分裂信号,它将破坏细胞周期控制机制,并进入一个被称为G0的G1期修改版本。G0期允许细胞执行其生理作用,而无需将能量转移至细胞分裂。当给予适当的有丝分裂信号时,一些成熟细胞可以重新进入G1期。G0和G1之间的转换可以快速持续地发生,就像在人类肠道细胞中观察到的那样(3到4天的周转率),而其他类型的细胞主要停留在G0中,很少分裂(肝细胞可能每年只分裂一次)。虽然完全有丝分裂的细胞类型多于有丝分裂后的细胞类型,但在多细胞生物体中永久留在G0(即有丝分裂后)的细胞绝对数量要多得多。
表4.1展示了几种不同的G0停留时间的细胞类型。完全有丝分裂细胞可以在整个成年期内复制,半有丝分裂细胞很少复制,有丝分裂后细胞在成熟期不复制。G1和G0之间转换的机制尚不清楚,但被认为在细胞衰老中起关键作用。
程序细胞死亡(凋亡)是机体发育和组织维持的正常部分
每天都有数以百万计的细胞分裂,取代已经死亡的细胞。需要新的细胞来确保有丝分裂组织保持高度功能化,细胞所在的器官既不收缩也不生长。为了在生长和死亡之间取得平衡,多细胞生物已经发展出一种高度调控的程序性细胞死亡系统,即凋亡(希腊语中“脱落”)系统,它可以清除受损的细胞。胎儿发育也依赖于细胞凋亡来塑造身体结构。据估计,在胎儿组织和器官发育过程中形成的所有细胞中,有50%通过细胞凋亡被清除。
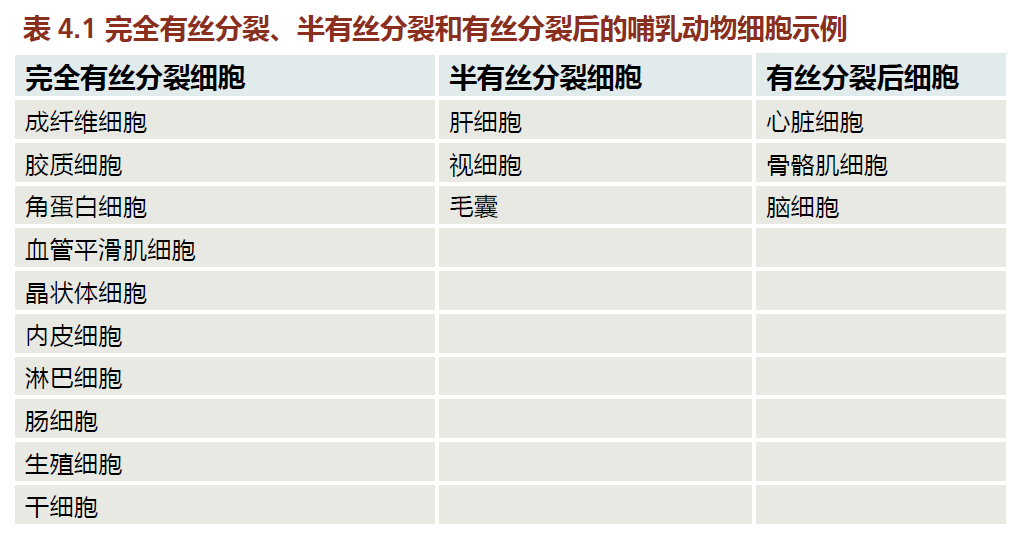
细胞凋亡可以通过两种机制启动,即外源性途径和内源性途径(又称线粒体途径)。在这两种情况下,被称为半胱天冬酶(caspases)的蛋白酶在调节导致细胞死亡的事件中起着关键作用。当来自邻近细胞或免疫细胞(称为杀伤性淋巴细胞)的细胞外信号激活称为Fas的跨膜“死亡受体”时,外源性途径开始;Fas属于肿瘤坏死因子(TNF)受体家族(图4.8)。在这两种情况下,细胞外信号蛋白都携带一个与死亡受体结合的Fas配体。Fas配体与Fas受体的结合启动了蛋白质与启动子半胱天冬酶的细胞内结合,形成死亡诱导信号复合物(DISC)。反过来,DISC激活半胱天冬酶,导致细胞成分的蛋白质降解,最终导致细胞凋亡。
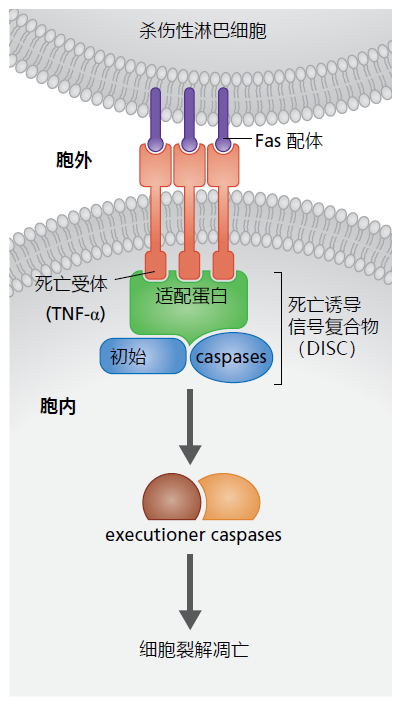
图4.8 外源性细胞凋亡。杀伤性淋巴细胞是一种免疫细胞,主要对病毒感染的细胞作出反应,携带Fas配体。Fas配体结合到受感染细胞的膜上的TNF受体的Fas结构域。Fas配体与受体的结合诱导细胞胞浆中死亡诱导信号复合物(DISC)的形成。反过来,DISC激活刽子手半胱天冬酶,导致细胞分裂和凋亡。
各种应激源(stressor)对DNA和细胞器的损伤激活了细胞凋亡的内在途径。这种途径的另一个名称是线粒体途径,因为细胞色素c是线粒体内膜内的一种蛋白质而得名,它诱导了细胞凋亡的初始事件。一个名为Bcl2的蛋白质家族通过阻止或诱导细胞色素c的释放来调节内在通路。因此,Bcl2蛋白质可以是促凋亡的或抗凋亡的,并且确保只有严重受损的细胞才会发生凋亡。抗凋亡Bcl2蛋白通常位于线粒体外膜上,其排列方式使细胞色素c不能离开细胞(图4.9)。当细胞损伤超过细胞内修复系统时,细胞质中高度保守的促凋亡蛋白BH3-only蛋白质结合并抑制抗凋亡蛋白的作用。反过来,线粒体膜对膜间蛋白质具有渗透性,它们被释放到细胞的细胞质中。然后,细胞色素c与一种名为Apaf1(凋亡蛋白酶激活因子-1)的蛋白质结合,该蛋白反过来又招募了一种启动子半胱天冬酶。Apaf1、细胞色素c和启动子半胱天冬酶形成一种称为凋亡体的大型蛋白质复合物,激活下游刽子手半胱天冬酶,从而启动凋亡的蛋白水解级联反应。
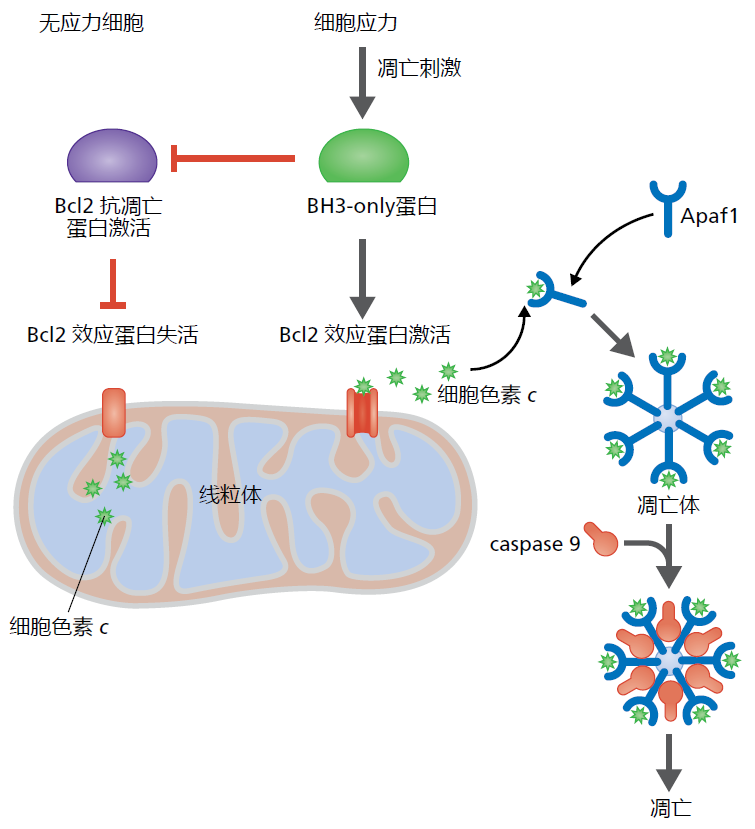
图4.9 内在凋亡。在无应力力细胞(左)中,Bcl2抗凋亡蛋白抑制位于线粒体外膜上的Bcl2效应蛋白。这些蛋白质确保细胞色素c留在线粒体中。在应力细胞(右)中,凋亡刺激激活BH3-only蛋白,进而抑制抗凋亡蛋白的作用。抑制抗凋亡蛋白会导致Bcl2效应蛋白的构象改变,从而使细胞色素c离开线粒体。细胞色素c结合并激活凋亡蛋白酶激活因子-1(Apaf1)。七个单独的Apaf1蛋白聚集在一起形成凋亡体。凋亡体招募刽子手caspase 9,导致细胞凋亡。
凋亡蛋白水解级联反应导致细胞内部组织断裂。在一个尚未完全阐明的过程中,细胞内部的碎片导致细胞表面蛋白质的重新排列,进而在组织内招募吞噬细胞(巨噬细胞)。由于巨噬细胞是由凋亡特异性因子而非免疫系统从组织内募集的,因此受损的细胞在不引发炎症反应的情况下被清除。这意味着在凋亡过程中没有邻近细胞受损。下一节将讨论另一种类型的细胞死亡,即细胞衰老,细胞衰老会导致周围组织受损,因为它会引发炎症反应。


