4.3 细胞衰老
细胞衰老理论预测,细胞功能的改变调节或“驱动”生物体的衰老。由于机体衰老反映了生殖期后功能的逐渐衰退,细胞分裂的衰退和最终丧失通常被视为细胞衰老的特征,这一时期被称为细胞衰老或复制性衰老。在这一节中,我们考虑细胞是否具有有限的寿命,如果是的话,这会如何影响整个机体衰老或长寿。你了解到,细胞衰老很可能反映了一种进化上保守的机制,有助于防止有丝分裂组织中的肿瘤发生。
一个错误将细胞衰老的发现推迟了50年
1912年,Alexis Carrel取出一片鸡心,放在一个容器中,容器顶部是鸡血浆和液化的鸡胚胎组织的混合物。血浆中含有形成细胞生长基质的蛋白质。液化的胚胎组织提供了生长所需的营养,尽管液体中成分的准确成分尚不清楚。几天后,鸡心上出现了新的细胞。在Montrose Burrows的帮助下,Carrel成为第一个在动物体外成功培养正常细胞的人。
在接下来的几天里,当液化的鸡胚胎组织耗尽,细胞占满空间时,培养物的生长放缓,然后停止。Carrel移除了一些细胞,将它们放置在一个新的容器中,并添加了新鲜的鸡胚组织和血浆。和以前一样,新培养基中的细胞分裂,直到达到培养皿的承载能力。1912年开始的细胞培养一直持续培养到1946年Carrel去世,从而形成了细胞不朽的教条。然而,科学家们了解到,Carrel液化鸡胚胎组织的方法并没有从血清中去除所有活细胞。也就是说,细胞培养不是不朽的;它只是一种培养物,每次喂食都会添加新的细胞。尽管如此,体外培养的细胞是不朽的信条已被广泛接受,近50年来几乎没有受到挑战。在培养基中生长的细胞是不朽的这一信念如此强烈,以至于有证据表明并非如此,这被视为技术错误的结果,并普遍归因于人类的错误。因此,这就是为什么在1961年,宾夕法尼亚州费城Wistar研究所的Leonard Hayflick和Paul Moorhead谨慎地报告了他们的发现,即人类胚胎成纤维细胞的体外培养在数次种群倍增后死亡。
Hayflick和Moorhead的研究发现开创了细胞衰老学领域
Hayflick和Moorhead对将正常细胞转化为恶性肿瘤的潜在生化机制感兴趣。他们使用人类胚胎成纤维细胞(这在1961年是合法的),因为正如他们所推断的那样,这些细胞没有暴漏在可能导致癌症发展的内在生物学机制的环境中。他们不再像Carrel那样直接在切碎的组织块上生长细胞。相反,来自胚胎组织的细胞通过结缔组织消化酶胰蛋白酶彼此分离,并放置在培养瓶中的生长培养基上(图4.10)。然后将细胞悬浮在含有必要营养和细胞生长因子的培养基中。
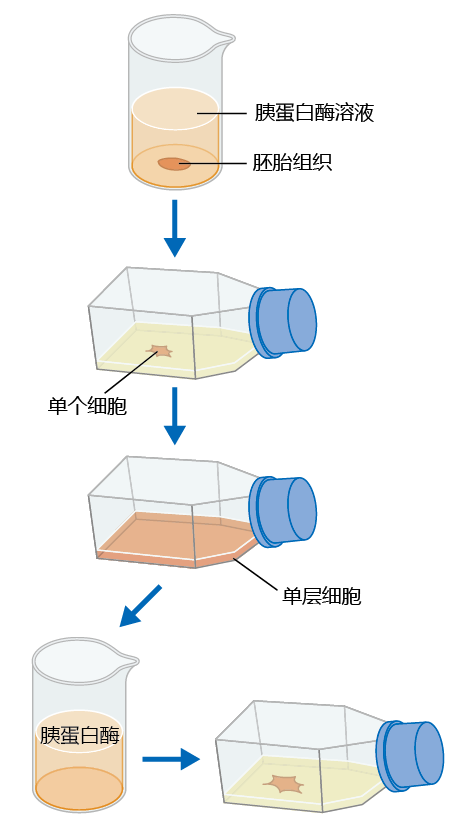
图4.10 用于确定培养细胞寿命的方法。成纤维细胞通过胰蛋白酶消化分离成单个细胞。然后将细胞放入含有无细胞的胎牛血清的培养瓶中。当细胞完全覆盖烧瓶中的培养基,没有更多的生长空间(接触抑制)时,它们再次被胰蛋白酶消化,一些分离的细胞像以前一样被重新贴壁生长。从胰蛋白酶消化到融合的每一代细胞被称为一个群体倍增。
在进行了几个月的实验后,经过几次细胞倍增,Hayflick和Moorhead发现一些细胞不再分裂。仔细观察表明,在40-60个种群加倍后,传代培养的细胞将停止分裂。在随后的几年里,有限数量的细胞群倍增被称为Hayflick界限。然而,细胞是不朽的教条在生物学家的思想中根深蒂固,以至于科学界不接受有限细胞数量倍增的第一个实验证据。Hayflick和Moorhead受到了该领域专家的批评,认为他们的细胞培养可能有染色体损伤,导致细胞群死亡,而且这种损伤在一种性别中可能比另一种性别更大。为了回应这一批评,Hayflick和Moorhead又进行了一次实验,评估了两性染色体的结构完整性,并确定了性别是否对存活率有影响。用Hayflick自己的话说,他们做了如下事情(图4.11):
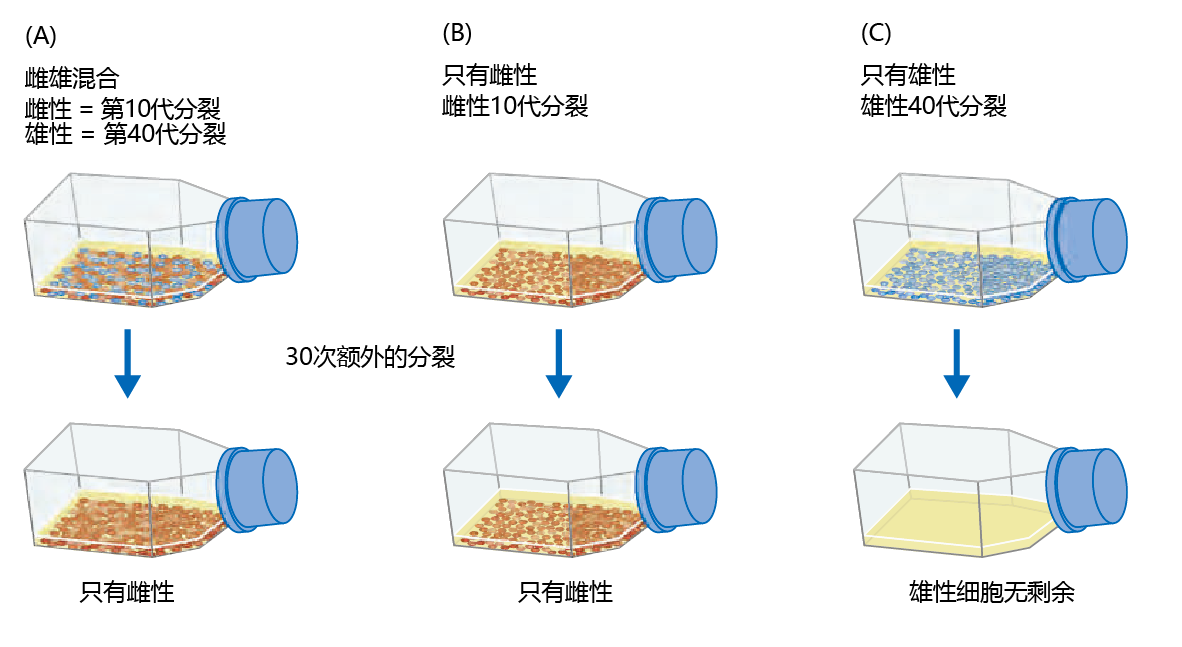
图4.11 Hayflick和Moorhead的实验,以确定在培养基中生长的细胞是否具有有限的寿命。Hayflick和Moorhead测试了三种不同的培养基。(A)分裂40次的人类男性细胞(蓝色),数量相同的分裂10次的人类女性细胞(红色)。继续分裂30次后,只有雌性细胞继续分裂。(B)已经分裂10次的女性细胞,并保持30次额外的分裂。在40次数量倍增后,雌性细胞仍在分裂。(C)分裂40次的男性细胞。再进行30次细胞倍增后,没有细胞可以存活。
我们在第10次转移培养(subcultivation)水平(年轻细胞)和第40次转移培养水平(老细胞)混合了等量的人类雌性细胞(通过性染色体分析确定)。我们还继续对不同性别的未混合细胞培养物进行传代培养…经过大约30多次转移培养后,我们观察了这三种培养基。在混合培养中,我们发现只有雌性细胞存在。混合液中的雄性细胞数周前就已经死亡,当时它们已经达到了50次转移培养的最大值。在我们决定研究混合物之前,纯雄性细胞培养物已经死亡数周。纯雌性细胞培养,就像混合物中的雌性细胞一样,仍然繁茂。(Hayflick和Moorhead,1961年)
毫无疑问,体外培养的细胞确实具有有限的寿命。至少对于培养中的细胞来说,对细胞寿命有限的衰老进化理论的预测是准确的。这些结果非常重要,因此细胞老年学诞生了一个新的研究领域——细胞衰老学,即细胞衰老的研究。
培养的细胞有三个生长阶段
除了证明细胞是致命的之外,Hayflick和Moorhead的实验首次确定了培养细胞的寿命特征。如图4.12所示,来源于一小群同源胚胎细胞分三个不同阶段生长。第一阶段的特点是,细胞从供体中取出并接种在第一种生长培养基上后,立即出现一个相当缓慢的生长期。这种缓慢增长可能会持续2-3个月,在此期间细胞可能会分裂10-12次。第一阶段很可能反映了细胞对新的体外环境的适应期。第一阶段的缓慢增长之后是第二阶段,这个阶段细胞快速且稳定的分裂,这可能会持续8-9个月(30-40次细胞倍增)。在第二阶段,可能发生突变,细胞寿命从有限转变为无限。最后,细胞培养进入第三阶段,这是一个细胞增殖率下降的时期,最终导致细胞分裂的丧失。Hayflick和Moorhead最初提出,第三阶段细胞在大约12个月时失去增殖。随后的研究发现,一个细胞亚群(sub-population)将停止复制,但在较长时间内保持生理活性。

图4.12 Hayflick和Moorhead最初描述的培养中有丝分裂细胞的生活史。第一阶段从原代培养开始,其特点是增殖速度缓慢,细胞翻倍。第二阶段的细胞生长迅速,达到峰值,约为其最大群体的75%。第二阶段的细胞可以自发或通过变异永生,并成为细胞系。种群倍增时间的增加和培养物的死亡发生在第三阶段(摘自Hayflick L,Moorhead PS.1961.Exp.Cell Res 25:585–621.经Elsevier许可)
细胞群在培养中的复制寿命结束的标准已被广泛接受,即细胞群在4周内未能翻倍。这一定义并不意味着种群中的所有细胞都失去了分裂能力,而只是大多数细胞失去了分裂能力。细胞就像整个有机体一样,以不均匀的速度衰老。在古老的、不加倍的群体中,许多单个细胞保留分裂的能力。(事实也恰恰相反:只翻了几倍的年轻群体中,有些细胞不再具有分裂能力。)如果从培养瓶中移除克隆,在4周内种群没有翻倍,则可以培养具有第二阶段复制特征的新种群。也就是说,已达到其增殖寿命终点的细胞群可能包含仍能分裂的单个细胞。事实上,一些克隆将开始种群的增殖寿命与它们来源的种群相同。与人类群体的寿命特征非常相似,细胞群体在个体衰老率和个体寿命方面存在显著差异。
种间比较表明,种群倍增速率因物种而异(表4.2)。此外,种群倍增速率似乎与寿命长短没有很强的相关性。普通实验室小鼠的平均寿命为3-4年,成纤维细胞增加了约15倍。人类的最大寿命为115-120年,胎儿成纤维细胞的数量增加了45-60倍(图4.13)。然而,鸡的最大寿命为6-10年,与短命小鼠相比,其种群倍增时间更接近长寿人类。
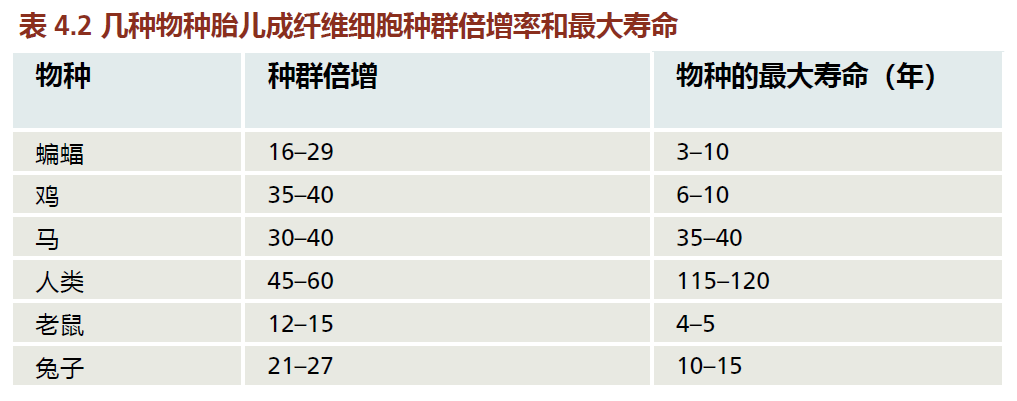

图4.13 实验室模拟的人类和小鼠细胞的胎儿成纤维细胞倍增时间。人类成纤维细胞培养最多有45-50倍。相反,小鼠成纤维细胞的细胞分裂速度在15-20倍后减慢,然后细胞通常会自发永生。
并非所有类型的细胞都有有限的群体倍增次数。从一些小鼠组织中分离出的成纤维细胞在II期生长时显示出无限数量的倍增,这一过程被称为自发永生化。灵长类和鸟类的细胞很少在培养基中自发长生不老,但它们可以通过操纵基因组而长生不老。例如,猿猴病毒40(SV40)T抗原基因对人类或其他灵长类成纤维细胞的转化(将DNA从一个物种的细胞或病毒导入另一个物种的细胞)导致种群的永生化。如框4.1所述,癌细胞也会经历无限数量的群体倍增。不朽的细胞被称为细胞系,由于其易于复制和统一的基因构成,已在生物学中得到广泛应用。
| 方框4.1 HENRIETTA的细胞缺失:是她的还是我们的? |
|
现代分子细胞生物学家采用的技术为几乎所有可能的研究问题提供了不朽的细胞系。通过基因工程或恶性肿瘤构建的细胞系可以商业化获得,也可以通过国家政府维护的细胞系储存库获得。然而,有一段时间,这样的细胞系并不存在。这一切在1951年的一个冬天发生了变化。 现年34岁的Henrietta Lacks是五个孩子的母亲,1951年2月9日来到巴尔的摩一家医院,开始接受宫颈恶性肿瘤的放射治疗。在医生用镭覆盖肿瘤之前,该医院的医生George Gey要求对肿瘤进行小样本检查。Gey对癌细胞的生长方式很感兴趣,但他无法长期培养其他类型肿瘤细胞。Henrietta的宫颈肿瘤细胞则不同。在将细胞置于生长培养基上数小时后,它们开始生长。Gey很快发现,他可以无限期地培养这些细胞,并开始向其他科学家提供亚培养,他用Henrietta Lacks的名字命名为HeLa。事实上,Jonas Salk在对人类进行测试之前,用的是HeLa细胞来测试他的脊髓灰质炎疫苗。 Henrietta Lacks于1951年10月4日去世,但HeLa细胞仍然是世界上使用最广泛的细胞系,并继续为科学家提供解决具体研究问题的可靠工具。然而奇怪的是,直到1975年,Henrietta Lacks的丈夫David Lacks和Lacks家族的其他成员才发现了HeLa细胞。很可能,这家人发现的原因是,研究人员需要这个家庭的DNA。HeLa细胞被广泛使用,以至于它们开始污染其他细胞系。研究人员需要从Henrietta Lacks的近亲那里提取DNA,以开发一种能够区分HeLa细胞和其他细胞类型的分析方法。 毫无疑问,许多人和公司都从HeLa细胞的使用和/或销售中获利。然而,Lacks一家还没有从Henrietta的细胞里赚到一分钱,他们也不太可能会赚到。美国最高法院裁定,从个人身上移除的细胞不再是该个人的财产。相反,细胞和/或组织属于负责移除细胞的人。在知情同意时,必须详细说明谁将从组织销售中获利。由于Henrietta的细胞被移除时没有得到知情同意,Lacks一家无权获得赔偿。 Henrietta Lacks的细胞必须归功于我们对细胞生物学的理解。此外,在捐赠者死亡后,她的细胞直接引发了关于谁拥有组织的争论。这场辩论虽然仍在进行中,但却导致了对捐赠者权利的监管。病人和捐赠者的权利现在是科学领域不可或缺的一部分,我们要感谢Henrietta Lacks的癌细胞。随着基因工程技术发展到人类克隆的极限,关于组织和细胞伦理治疗的讨论将变得更加重要。 |
衰老细胞有几个共同特征
复制停止是晚期传代细胞的主要特征,这些细胞是接近Hayflick极限的细胞群的一部分,但衰老细胞群中也常见其他一些特征,包括形态改变、细胞功能改变、细胞分裂停滞和免疫相关功能的改变(表4.3)。衰老细胞通常表现为细胞增大,包括细胞核和多核细胞的增大。此外,由于细胞外基质蛋白酶和胶原酶的分泌增加,细胞之间的距离变得更大。活细胞外基质蛋白的减少也可能导致复制的减缓,因为细胞没有足够的物质来锚定自身。

复制的放缓似乎是由于细胞周期的延长,这很可能反映了G1-S期界面分子检查点的活性。细胞内有丝分裂信号仍然对细胞外有丝分裂原有反应,这一观察结果支持了G1期衰老细胞群体中复制的抑制。这些观察结果表明,细胞衰老可能是由复制机制中的错误引起的,尽管尚未获得支持这一理论的一致数据。
衰老群体中的细胞功能普遍降低,包括DNA、RNA和蛋白质合成速率降低。考虑到这些重要细胞成分的合成速率在很大程度上调节着细胞的整体功能,衰老细胞群中生理功能的普遍下降并不令人惊讶。此外,衰老细胞群的特征是细胞内“垃圾”的增加。这种垃圾反映了衰老细胞分解和代谢无功能蛋白质的能力下降。最后,衰老细胞分泌的蛋白质增加,其中包括多种炎症细胞因子,这些蛋白质可激活炎症反应。衰老细胞释放的蛋白质无处不在,因此它们被命名为衰老相关的分泌表现型(SASP)。
细胞衰老可以保护细胞抵抗癌症
从Hayflick和Moorhead对细胞衰老的首次描述开始,许多科学家质疑体外模型作为整个生物体衰老描述的价值。尽管毫无疑问,生物体的衰老一定反映了细胞功能障碍,但成人真核生物中的大多数细胞都是有丝分裂后的。因此,目前尚不清楚基于细胞分裂停止的衰老模型如何为主要在没有细胞分裂的情况下发生的衰老过程添加有价值的信息。虽然细胞衰老的支持者经常指出,种群倍增率与物种寿命相关,但这些相关性充其量也很弱,并非所有物种都存在这种相关性。此外,从老年人身上提取的有丝分裂体细胞通常可以显示出强大的群体倍增率。
大多数生物衰老学家都同意,细胞衰老本身并不直接反映有丝分裂后的生物体的衰老机制。相反,细胞衰老似乎是一种抑制肿瘤形成的机制。回想一下,如果有丝分裂细胞没有及时收到有丝分裂信号,它们在胞质分裂后将进入G0期,有丝分裂沉默但代谢活跃。这些细胞将保持在G0状态,也称为静止状态,直到收到有丝分裂信号,然后重新进入细胞周期。一些细胞被认为在细胞周期中获得了未修复的损伤,但在胞质分裂后会转变为衰老细胞。衰老细胞在代谢上保持活跃,但会从细胞周期中永久性地移除,这一阶段被称为永久性生长停滞。永久性生长停滞将消除细胞转化为癌细胞的任何机会,肿瘤具有无限的生长潜力。此外,衰老细胞似乎有自己的自杀程序将其从组织中移除,这一程序与凋亡截然不同。也就是说,SASP引起的炎症反应会将细胞从组织中移除,并允许一个新细胞在没有损伤的情况下替换它。
诱导细胞衰老的机制尚不清楚
描述细胞如何选择进入衰老的分子途径尚不清楚。我们的知识通常是通过观察获得,而不是直接看到机制。此外,关于细胞衰老的绝大多数知识来自于培养的未分化成纤维细胞。也就是说,与细胞衰老相关的途径是发生在体内还是仅仅反映了培养条件尚待确定。这不是小事。在实验室内部以及不同实验室之间,培养条件可能存在很大差异,通常会导致相互矛盾的结果。虽然从受损细胞到衰老的过程涉及许多不同的分子途径,但在假设因果关系时应谨慎。
似乎诱导细胞衰老需要激活两条重要的肿瘤抑制途径。一个是p53途径,你之前了解过(参见题为“p53途径可以在G1-S相变中阻止DNA复制”的部分,以及图4.5)。回想一下,G1期到S期的DNA复制的错误会使得p53蛋白分子被激活。一旦错误被修复,p53被降解,细胞周期继续。然而,如果损伤无法修复,p53仍保持活性并抑制细胞周期的进展。细胞周期的抑制加上DNA损伤通常会引发凋亡反应。由于目前尚不清楚的原因,一些细胞被引导到衰老而不是凋亡,尽管我们在下一节中描述了DNA不稳定性如何导致细胞选择衰老。
第二个重要的细胞衰老途径涉及p16肿瘤抑制蛋白家族中的两种蛋白质,p16 ink4a(也称为细胞周期蛋白依赖性激酶抑制剂)和ARF(alternate reading frame)。蛋白p16 ink4a通过抑制细胞周期蛋白依赖性激酶(S-细胞周期蛋白和细胞周期蛋白依赖性激酶启动DNA复制)在G1期延迟细胞周期的进行。ARF通过抑制标记p53降解的蛋白质来阻止细胞周期的进行(译者注:p53蛋白抑制细胞周期,为了进行分裂必须降解p53蛋白,降解p53蛋白之前先给p53蛋白做一个蛋白质标记,表示要降解,ARF抑制这种蛋白质来标记p53蛋白);p53积聚并阻止细胞进入S期。


