第四节 细胞及生物大分子的动态变化
一、荧光漂白恢复技术
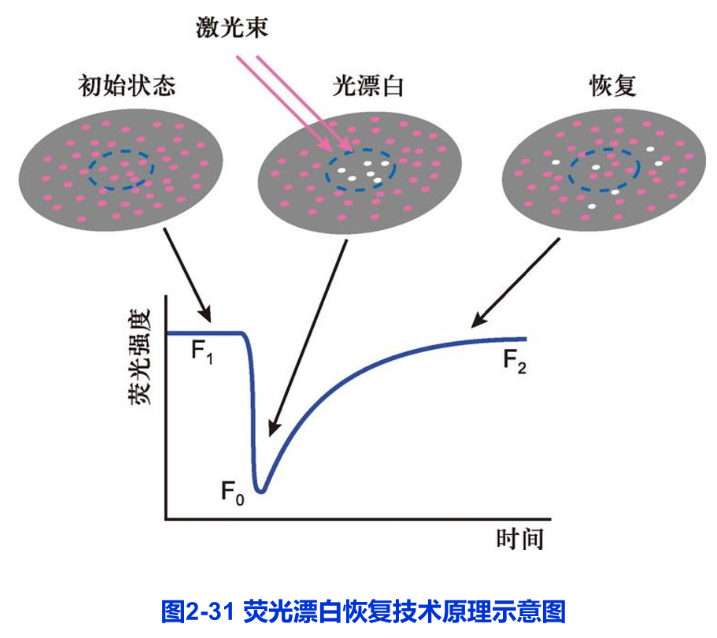
荧光漂白恢复(fluorescence photobleaching recovery FPR)技术是使用亲脂性或亲水性的荧光分子,如荧光素、绿色荧光蛋白等与蛋白或脂质偶联,用于检测所标记分子在活体细胞表面或细胞内部的运动及其迁移速率。FPR技术的原理是:利用高能激光束照射细胞的某特定区域,使该区域内标记的荧光分子发生不可逆的淬灭,这一区域称光漂白(photobleaching)区。随后,由于细胞中脂质分子或蛋白质分子的运动,周围非漂白区的荧光分子不断向光漂白区迁移。结果使光漂白区的荧光强度逐渐地恢复到原有水平。这一过程称荧光恢复(fluorescence recovery)。荧光恢复的速度在很大的程度上反映荧光标记的脂质或蛋白质在细胞中运动速率(图2-31)。FPR技术不仅能给出活细胞内脂质或蛋白质运动的定性的结果,而且还可以获得某些定量的信息。如膜脂分子的扩散系数和蛋白质的迁移率等,从而有助于解决细胞内脂质和蛋白质分子的动态变化以及与其他成分相互作用等一系列问题。
二、酵母双杂交技术
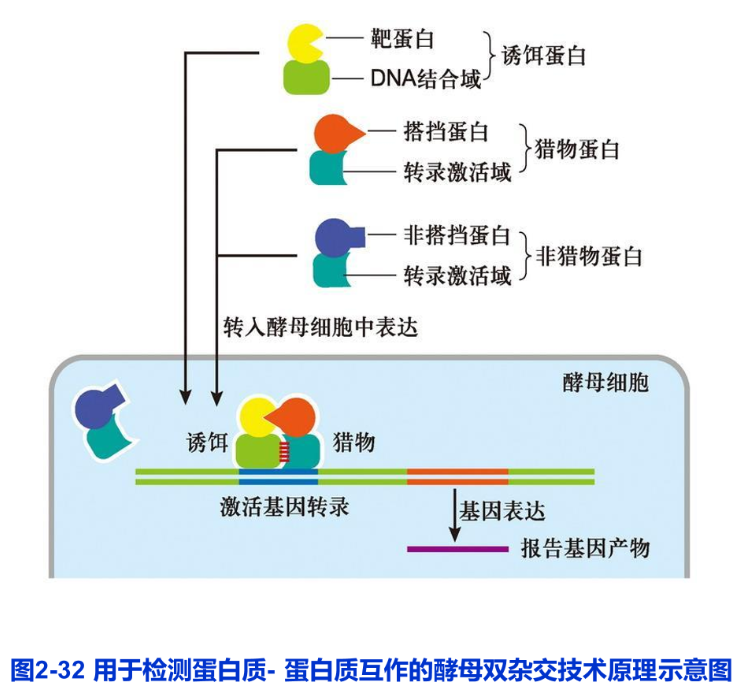
酵母双杂交系统(yeast two-hybrid system)是一种利用单细胞真核生物酵母在体内分析蛋白质一蛋白质相互作用的系统。该技术由Feds等人于1989年首次建立,目前已得到广泛的应用。酵母双杂交系统的建立得益于对真核生物调控转录起始过程的认识和DNA重组质粒的构建技术。细胞基因转录起始需要转录激活因子的参与,转录激活因子一般由两个或两个以上相互独立的结构域构成,即DNA结合域(DNA binding domain, DB)和转录激活域(activation domain,AD)。前者可识别DNA上的特异转录调控序列并与之结合;后者可与其他成分作用形成转录复合体的,从而启动它所调节的基因的转录。酵母双杂交系统正是利用这个原理来研究蛋白质一蛋白质的相互作用。如果要证明蛋白A是否与蛋白B在细胞内相互作用,或寻找与蛋白A可能发生作用的蛋白,则可分别制备DB与蛋白A的融合蛋白(又称“诱饵”,bait),以及AD与蛋白B或可能与蛋白A发生作用蛋白的融合蛋白(又称“猎物”,prey)。如果蛋白A与蛋白B或其他蛋自在细胞内相互结合,则可形成与转录激活因子类似的具有的DB和AD结构域的复合物,从而启动报告基因的表达。反之,则报告基因不表达。这样就可以分析蛋白质一蛋白质之间的相互作用(图2-32)。
酵母双杂交系统是一种具有高灵敏度的,在活细胞内研究蛋白质相互作用的实验技术。该技术既可以用来硏究哺乳动物,也可以用来硏究高等植物蛋白质之间的相互作用。因此,它在许多的研究领域诸如细胞信号转导网络中各种蛋白质的相互关系等方面有着广泛的应用。值得提出的是,由于“猎物”蛋白可能与“诱饵”蛋白存在非特异性结合等原因,所以该实验系统有可能存在假阳性的问题。目前,酵母双杂交技术还在不断完善,并由此衍生出一些相关的新技术
三、荧光共振能量转移技术
荧光共振能量转移(fluorescence resonance energy transfer,FRET)技术是用来检测活细胞内两种蛋白质分子是否直接相互作用的重要手段。其基本原理是:在一定波长的激发光照射下,只有携带发光基团A的供体分子可被激发出荧光A,而同一激发光不能激发携带发光基团B的受体分子发出荧光B。然而,当供体所发出的荧光光谱A与受体上的发光基团的吸收光谱B相互重叠,并且两个发光基团之间的距离小到一定程度时,就会发生不同程度的能量转移现象,即以供体的激发波长A激发时,可观察到受体发射的荧光B,这种现象称为FRET(图2-33)。在体内,如果两个蛋白质分子的距离在10nm之内,就可能发生FRET现象,由此认为这两个蛋白质存在着直接的相互作用。
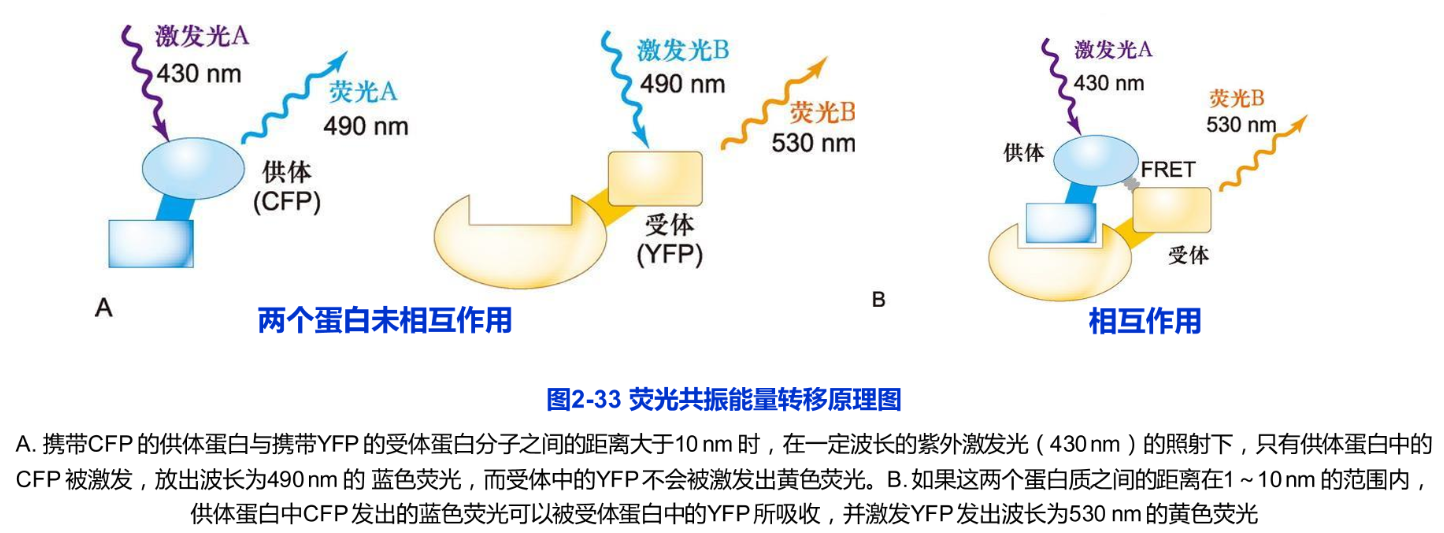
FRET技术用于检测体内两种蛋白质之间是否存在直接的相互作用。例如,选择青色荧光蛋白(CFP)和黄色荧光蛋白(YFP)的基因分别与目的蛋白(或称供体蛋白和受体蛋白)的基因融合表达。如果这两个融合蛋白之间的距离大于10nm时,在一定波长的激发光照射下,只有供体蛋白中的CFP被激发,放出蓝色荧光。如果这两个融合蛋白之间的距离在5~10nm的范围内时,供体蛋白中CFP发出的荧光可以被受体蛋白中的YFP所吸收,并激发YFP发出黄色荧光。此时可以通过测量CFP的荧光强度的损失量来判断这两个蛋白是否存在相互作用。两个蛋白距离越近,CFP所发出的荧光被YFP接收的量就越多,检测器所接收到的蓝色荧光就越弱,而黄色荧光就越强。反之就不会出现FRET现象。荧光共振能量转移的效率在很大程度上反映了细胞内两种蛋白相互作用的可能性与作用的强弱。
四、放射自显影技术
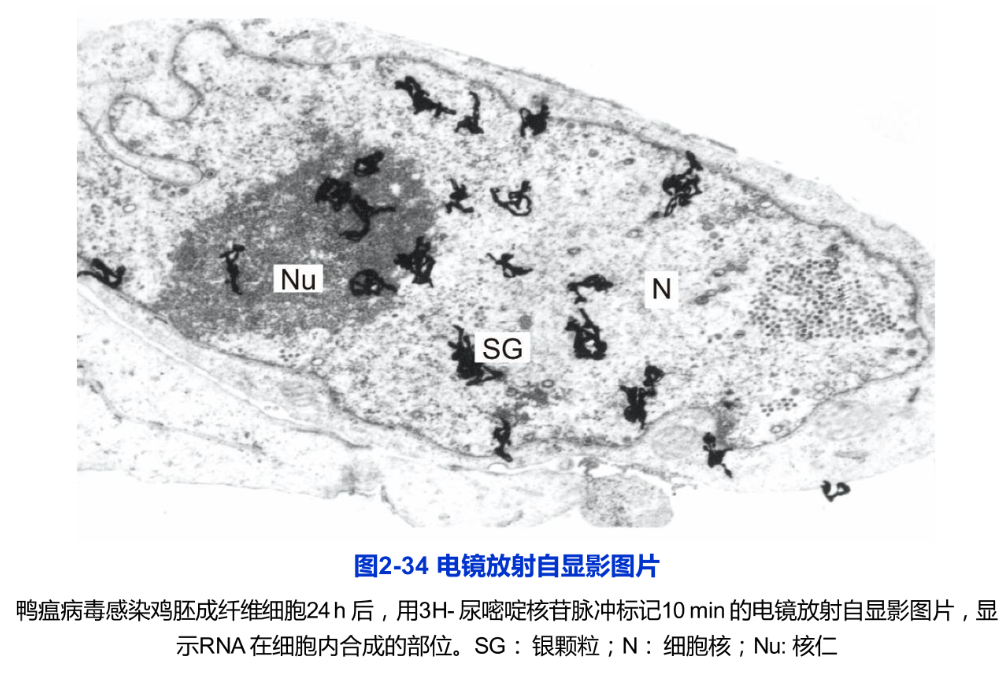
放射自显影技术(autoradiography)是利用放射性同位素的电离射线对乳胶(含AgBr或AgCl)的感光作用,对细胞内生物大分子进行定性、定位与半定量研究的一种细胞化学技术。对细胞或生物体内生物大分子进行动态研究和追踪(pulse-chase)是这一技术独具的特征。放射自显影技术包括两个主要步骤,即同位素标记的生物大分子前体的掺入和细胞内同位素所在位置的显示。常用于生物学研究的同位素及其性质如表2-3所示,根据实验要求可选择合适的同位素。
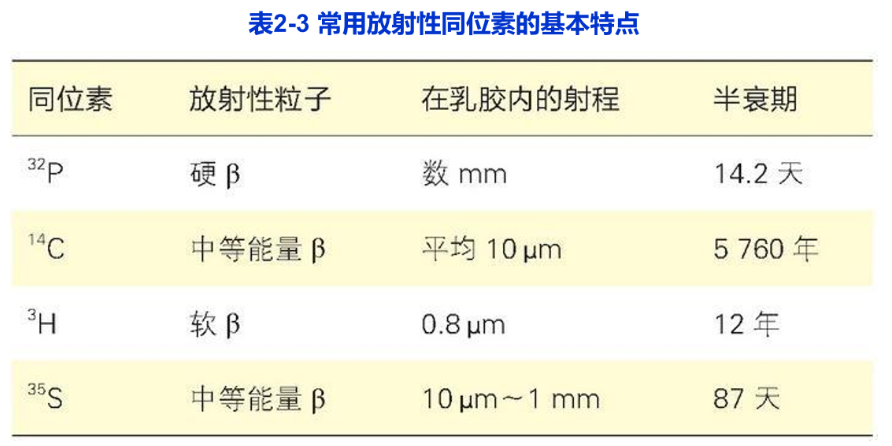
研究DNA合成时通常用氚(3H)标记的胸腺嘧啶脱氧核苷(3H-TdR),研究RNA合成用氚标记的尿嘧啶核苷(3H-U);在硏究含硫蛋白分子代谢时,可用35S标记的蛋氨酸和半胱氨酸,3H或14C标记的蛋氨酸、亮氨酸等也是常用于蛋白质合成的前体化合物。
显微放射自显影的基本实验步骤如下:首先用合适的放射性前体分子标记机体或细胞,根据实验的需要,按标记的持续时间分为持续标记和脉冲标记。标记后的组织与细胞可按常规方法制片,在暗室中向样品表面均匀地敷一层厚3~10μm的乳胶膜,然后在暗盒中曝光(或称自显影)数天,再经显影、定影后于显微镜下观察。细胞中银颗粒所在的部位即代表放射性同位素的标记部位。
电镜放射自显影技术的基本原理与显微放射自显影相同,实验操作过程亦相似。与显微放射自显影不同之点是,对样品制备与敷乳胶的要求更为严格,曝光时间般长达数月(图2-34)。