第三节 细胞培养与细胞工程
一、细胞培养
细胞培养是当前细胞生物学乃至整个生命科学研究与生物工程中最基本的实验技术。干细胞生物学的发展及其应用在很大程度上基于细胞培养技术的发展。细胞培养包括原核生物细胞(如大肠杆菌)、真核单细胞(如酵母菌、四膜虫)、植物细胞与动物细胞的培养以及与此密切相关的病毒的培养。本节扼要介绍动植物细胞培养技术以及与细胞培养直接相关的一些技术。
(一)动物细胞培养
体外培养的动物细胞可分为原代细胞(primary culture cell)与传代细胞(subculture cell)。原代细胞是指从机体取出后立即培养的细胞,进行传代培养后的细胞即称为传代细胞。也有人把传至10代以内的细胞统称为原代细胞培养。适应在体外培养条件下持续传代培养的细胞称为传代细胞。
任何动物细胞的培养均需从原代细胞培养做起。动物很多组织的细胞,如幼年动物的肾、肺、卵巢、精巢、肌肉及肿瘤等组织的细胞较易培养,而神经细胞等则较难培养。原代细胞培养步骤如下:首先取出健康动物的组织块,剪碎,用浓度与活性适中的胰酶或胶原酶与EDTA(螯合剂)等将细胞连接处消化使其分散,给予良好的营养液与无菌的培养环境(接近体温与体内pH),在培养中进行静置或慢速转动培养。但不论用何种培养液一般都要加一定量的小牛(或胎牛)血清,这样细胞才能很好地贴壁生长与分裂(图2-28A)。
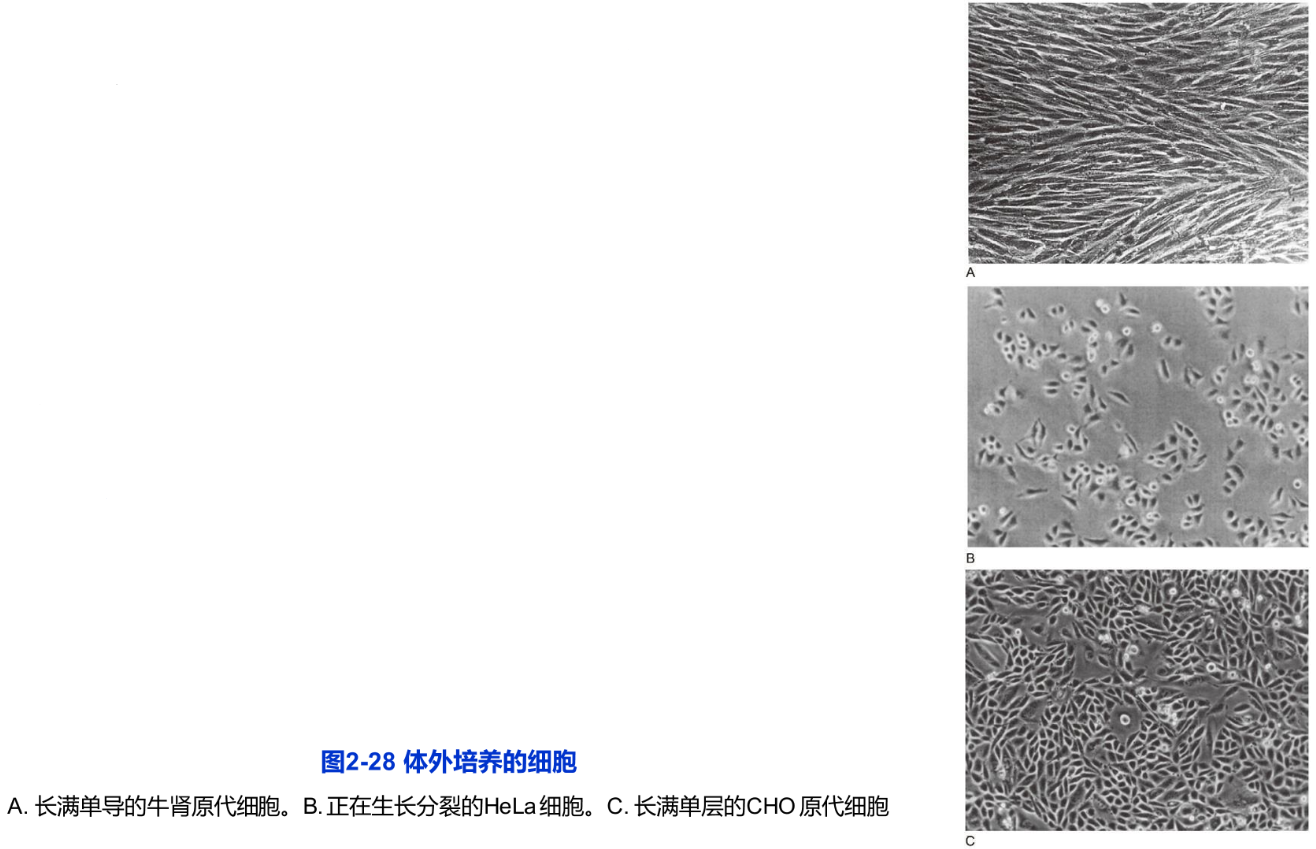
分散的细胞悬液在培养瓶中很快(在几十分钟至数小时内)就贴附在瓶壁上,称为细胞贴壁。分散呈圆球形的细胞一经贴壁就迅速铺展并开始有丝分裂,逐渐形成致密的细胞单层,称为单层细胞(single layer cell),这种培养方法称为单层细胞培养。
原代培养的细胞一般传至10代左右就不易传下去了,细胞生长出现停滞,大部分细胞衰老死亡,但有极少数细胞可能渡过“危机”而传下去。这些存活的细胞一般又可顺利地传40~50代次,并且仍保持原来染色体的二倍体数量及接触抑制的行为,很多学者把这种传代细胞称作细胞系(cell line)。一般情况下(胚胎干细胞等除外),当细胞传至50代以后又要出现“危机”难以再传下去。这种传代次数有限的体外培养细胞通常称为有限细胞系(finite cell line)。但在传代过程中如有部分细胞发生了遗传突变,并使其带有癌细胞的特点,有可能在培养条件下无限制地传代培养下去,这种传代细胞称为永生细胞系(infinite cell line),或连续细胞系(continuous cell line)。该细胞系细胞的根本特点是染色体明显改变,一般呈亚二倍体或非整倍体,失去接触抑制,容易传代培养。HeLa细胞系(来自宫颈瘤细胞)BHK21(baby hamster kidney)细胞系与CHO(Chinese hamster ovany)细胞系等都是常用的连续细胞系(图2-28B、C)。依靠这些细胞系做了大量卓有成效的研究工作。
用单细胞克隆培养或通过药物筛选的方法从某一细胞系中分离出单个细胞,并由此增殖形成的、具有基本相同的遗传性状的细胞群体称为细胞克隆。该细胞群体经过生物学鉴定,如具有特殊的遗传标记或性质,这样的细胞系可以称为细胞株(cell strain)。
体外培养的细胞,不论是原代细胞还是传代细胞,一般不能保持体内原有的细胞形态。但大体可以分为两种基本形态:成纤维样细胞(fibroblast like cell)与上皮样细胞(epithelial like cell)此外还有一些可移动的游走细胞。
某些传代细胞还可用悬浮方法培养。其培养条件比较复杂,悬浮培养的最大优点是在有限的培养液中获得大量细胞。
(二)植物细胞培养
目前植物细胞培养主要有两种类型:
(1)细胞培养 常用单倍体细胞培养,这种培养方法主要用花药在人工培养基上进行培养。可以从小孢子(雄性生殖细胞)直接发育成胚状体,然后长成单倍体植株。单倍体细胞培养在植物育种中已取得了很大成就。
(2)原生质体培养 一般用植物的体细胞(二倍体细胞),先经纤维素酶处理去掉细胞壁,去壁的细胞称为原生质体(protoplast)。原生质体在无菌培养基中可以生长与分裂,经过诱导分化最终可长成植株。也可以用不同植物的原生质体进行融合与体细胞杂交,由此而获得体细胞杂交的植株。转基因植物细胞的培养与分化的研究是植物基因工程的基础。
目前在植物无性繁殖中常采用植物组织培养,即分离出小块的植物体,又称外殖体(explant),在体外无菌条件下进行培养,形成愈伤组织(callus),即植物创面的新生组织。在一定条件下,诱导分化最终长成植株。
二、细胞工程
细胞工程是生物工程的重要领域之一。细胞工程所涉及的主要技术包括细胞培养、细胞分化的定向诱导、细胞融合和显微注射等。通过细胞融合技术发展起来的单克隆抗体技术已取得了重大成就。细胞工程与基因工程结合,前景尤为广阔。
(一)细胞融合与单克隆抗体技术
两个或多个细胞融合成一个双核或多核细胞的现象称为细胞融合(cell fusion)。介导动物细胞融合常用的促融剂有灭活的病毒(如仙台病毒)或化学物质(如聚乙二醇,PEG);植物细胞融合时,要先用纤维素酶去掉细胞壁,然后才便于原生质体融合。20世纪80年代又发明了电融合技术(electrofusion method)。将悬浮细胞在低压交流电场中聚集成串珠状细胞群,或对相互接触的单层培养细胞,再施加高压电脉冲处理使其融合。
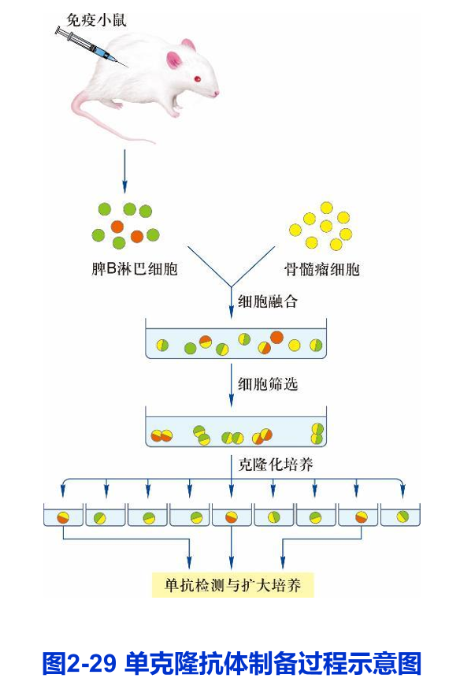
1975年,英国科学家C. Milstein和G.J.F. Kohler将产生抗体的淋巴细胞同肿瘤细胞融合,成功地建立了B淋巴细胞杂交瘤技术(B- lymphocyte hybridoma technique)用于制备单克隆抗体(monoclonal antibody),他们因此而获得1984年的诺贝尔生理学或医学奖。动物受到外界抗原刺激后可激发B淋巴细胞活化,产生相应的抗体,但B淋巴细胞在体外难以增殖,而一些骨髓瘤细胞[TK(胸苷激酶)或 HGPRT(次黄嘌呤鸟嘌呤磷酸核糖)缺陷型]不分泌抗体,但在体外培养条件下可以无限传代。为了大量制备纯一的单克隆抗体,Milstein和Kher把小鼠骨髓瘤细胞与经绵羊红细胞免疫过的小鼠脾细胞(B淋巴细胞)在聚乙二醇或灭活的病毒的介导下发生融合。融合后的杂交瘤细胞具有两种亲本细胞的特性,一方面可分泌抗绵羊红细胞的抗体另一方面像肿瘤细胞一样,可在体外培养条件下或移植到体内无限增殖。由于骨髓瘤细胞缺乏TK或 HGPRT,在含氨基蝶呤的培养液内不能成活。只有融合细胞才能在含HAT(次黄嘌呤、氨基蝶呤和胸腺嘧啶核苷)的培养液内通过旁路合成核酸而得以生存。通过HAT选择培养和细胞克隆,可以获得能大量分泌单克隆抗体的杂交瘤细胞株。单克隆抗体的制备过程如图2-29所示单克隆抗体技术最主要的优点是可以用混合性的异质抗原制备出针对某单一性抗原分子上特异决定簇的同质性单克隆抗体。单克隆抗体技术与基因克隆技术相结合为分离和鉴定新的蛋白质和基因开辟了一条广阔途径。而且在临床诊断与肿瘤等疾病的治疗中也具有重要作用。
(二)显微操作技术与动物的克隆
真核细胞是由细胞核和细胞质两大部分组成的,为了探明核质相互作用的机制,科学家们创建了细胞拆合技术。所谓细胞拆合,就是把细胞核与细胞质分离开来,然后把不同来源的胞质体(cytoplast)和核质体(karyoplast)相互组合,形成核质杂交细胞。
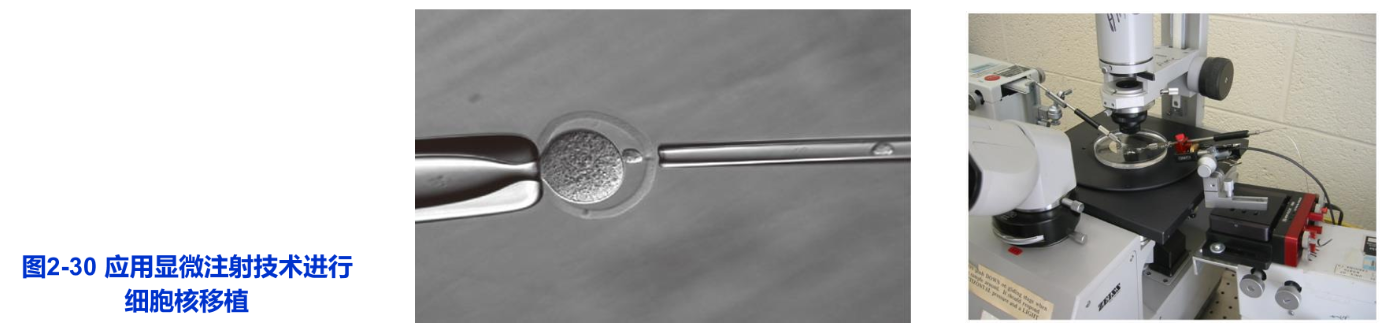
细胞拆合可以分为物理法和化学法两种类型。物理法就是用机械方法或短波光把细胞核去掉或使之失活,然后用微吸管吸取其他细胞的核,注入去核的细胞质中,组成新的杂交细胞。这种核移植必须用显微操纵仪进行操作。化学法是用细胞松弛素B(cytochalasin B)处理细胞,细胞出现排核现象,再结合离心技术,将细胞拆分为核质体和胞质体两部分。显微操作(micromanipulation)技术是早期建立的一种实验胚胎学技术,即在显微镜下,用显微操作装置对细胞进行解剖和微量注射(microinjection)的技术。现在显微操作装置的设计愈来愈精密,不仅用于核移植,而且亦可对细胞核进行解剖和向核内注入基因(图2-30)。
细胞拆合、显微注射与现代分子生物学技术相结合使这些经典的胚胎学技术展现出极大的潜力,它不仅成为核质关系、细胞内某种mRNA或蛋白质功能等基础研究的重要手段,而且在转基因动物、高等动物的克隆方面的理论与实践研究中取得了重大的突破。


