第一节 细胞质膜的结构模型与基本成分
一、细胞质膜的结构模型
人们借助光学显微镜发现了细胞,但在此后的几百年里却一直没有观察到细胞质膜,甚至有人怀疑细胞是否有一个确切的边界结构。20世纪50年代初随着电子显微镜技术的发展,质膜的超微结构才得以显示。但是,人们也并未因此感到惊奇,因为在此几十年前,细胞生理学家在硏究细胞内渗透压时就已证明质膜的存在。
1925年,E. Gorter和F. Grendel用有机溶剂抽提人的红细胞质膜的膜脂成分,以便测定膜脂单层分子在水面的铺展面积,发现它是红细胞表面积的二倍,这结果提示了质膜是由双层脂分子构成的。随后,人们发现质膜的表面张力比油一水界面的表面张力低得多,已知脂滴表面如吸附有蛋白质成分则表面张力降低,因此H. Davson和JF. Danielli推测,质膜中含有蛋白质成分并提出“蛋白质一脂质一蛋白质”的三明治式的质膜结构模型。这一模型影响达20年之久。
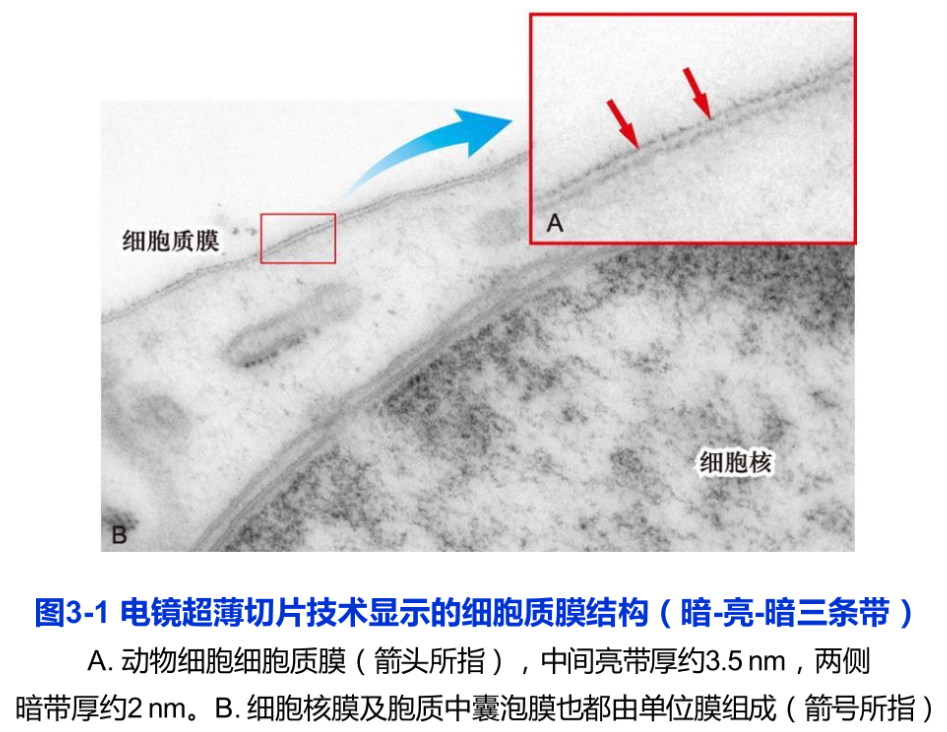
1959年,J.D. Robertson根据电子显微镜观察的结果提出了单位膜模型(unit membrane model),发展了三明治模型,并大胆地推断所有的生物膜都由蛋白质—脂质一蛋白质的单位膜构成。这一模型得到X射线衍射分析结果的支持。如果用锇酸固定细胞时,由于锇酸与磷脂极性头部基团亲合力极强,所以在电镜超薄切片中的细胞质膜显示出“暗一亮—暗”三条带,两侧的暗带厚度约2nm,推测是蛋白质,中间亮带厚度约3.5mm,推测是脂双层分子,整个膜的厚度约7.5nm(图3-1)随后的一些实验,如细胞融合结合免疫荧光标记技术证明,质膜中的蛋白质是可流动的,电镜冷冻蚀刻技术显示了双层膜脂中存在膜蛋白颗粒。
在此基础上,S. J. Singer和G.L. Nicolson于1972年提出了生物膜的流动镶嵌模型(fluid mosaic model)。流动镶嵌模型得到各种实验结果的支持,奠定了生物膜的结构与特征的基础(图3-2),从而激发人们对膜蛋白与膜脂的相互作用及其功能的深入探索。1975年N. Unwin和 Henderson首次报道了古核生物盐细菌的质膜蛋白—菌紫红质(bacteria rhodopsin)的三维结构它是一个跨膜7次的膜蛋白,通过蛋白质的疏水结构域“镶嵌”在脂双层中,利用光能完成质子的转运。流动镶嵌模型主要强调:①膜的流动性,即膜蛋白和膜脂均可侧向运动;②膜蛋白分布的不对称性,有的结合在膜表面,有的嵌入或横跨脂双分子层。
1988年K. Simons和G. van Meer提出的脂筏模型(lipid raft model)是对膜流动性的新的理解。该模型认为在甘油磷脂为主体的生物膜上,胆固醇、鞘磷脂等富集区域形成相对有序的脂相,如同漂浮在脂双层上的“脂筏”一样载着执行某些特定生物学功能的各种膜蛋白(图3-3)。脂筏最初可能在高尔基体上形成,最终转移到细胞质膜上,有些脂筏可在不同程度上与膜下细胞骨架蛋白交联。据推测,一个直径100nm的脂筏可载有600个蛋白质分子。目前已发现几种不同类型的脂筏,它们在细胞信号转导、物质的跨膜运输及病原微生物侵染细胞过程中可能起着重要的作用。脂筏模型虽然还不尽完善,但得到了越来越多的实验证据的支持。
目前对生物膜结构的认识可归纳如下(图3-2B,图3-3):
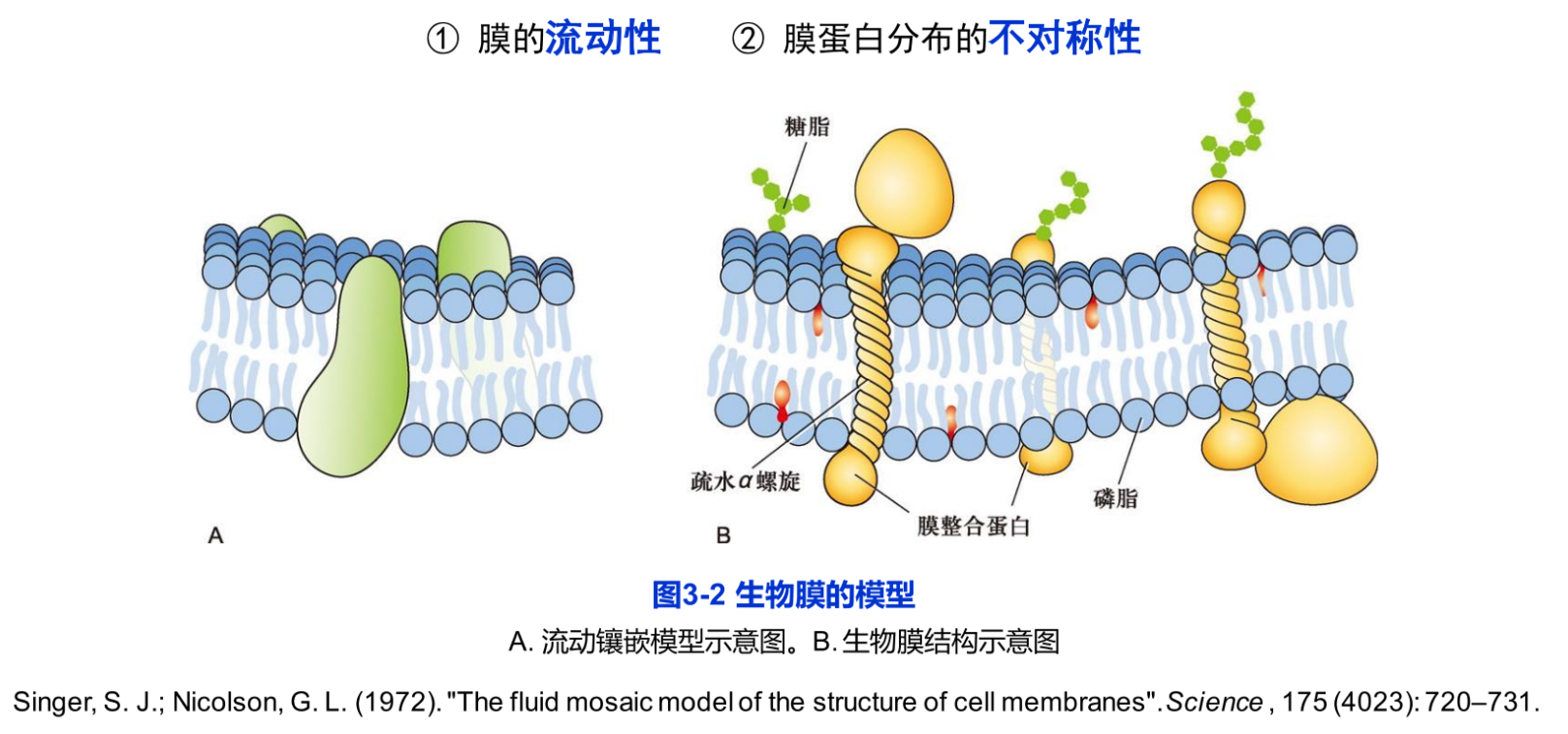
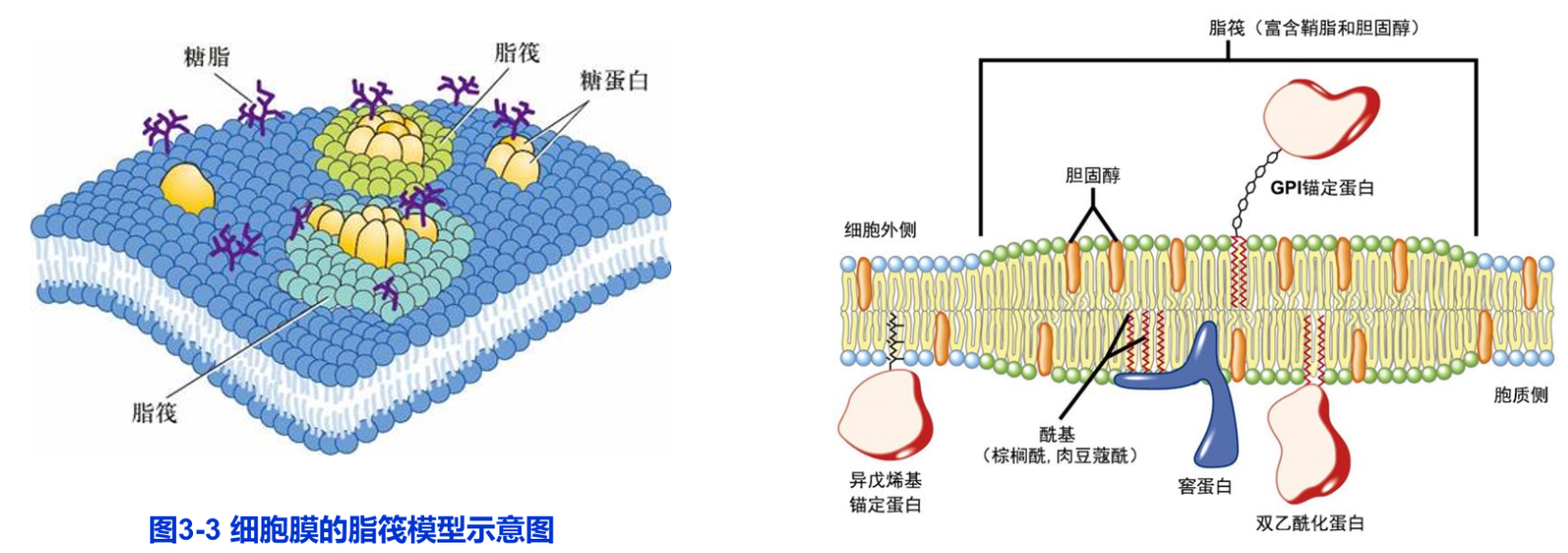
(1)具有极性头部和非极性尾部的磷脂分子在水相中具有自发形成封闭的膜系统的性质,磷脂分子以疏水性尾部相对,极性头部朝向水相形成磷脂双分子层(phospholipid bilayer),每层磷脂分子称为一层小叶(leaflet)。脂分子是组成生物膜的基本结构成分,尚未发现在生物膜结构中起组织作用的蛋白质。但在脂筏中存在某些有助于脂筏结构相对稳定的功能蛋白。
(2)蛋白质分子以不同的方式镶嵌在脂双层分子中或结合在其表面,蛋白质的类型、蛋白质分布的不对称性及其与脂分子的协同作用赋予生物膜各自的特性与功能。
(3)生物膜可看成是蛋白质在双层脂分子中的二维溶液。然而膜蛋白与膜脂之间、膜蛋白与膜蛋白之间及其与膜两侧其他生物大分子的复杂的相互作用,在不同程度上限制了膜蛋白和膜脂的流动性。同时也形成了赖以完成多种膜功能的脂筏、纤毛和微绒毛等结构(图3-4)。

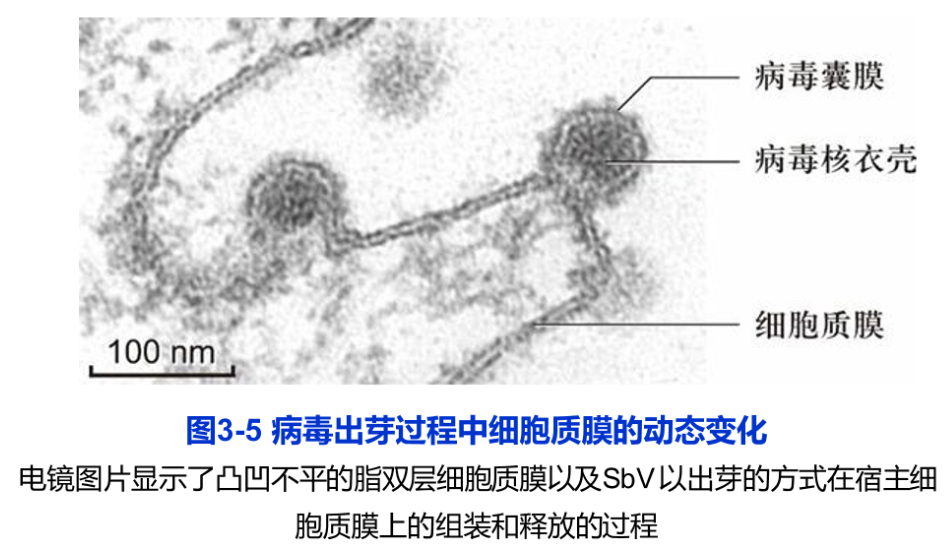
(4)在细胞生长和分裂等整个生命活动中(如细胞分裂、内吞等过程中的某些区域),生物膜在三维空间上可出现弯曲、折叠、延伸以及非脂双层状态等改变,处于不断的动态变化中,从而保证了诸如细胞运动、细胞增殖等各种代谢活动的进行。某些有囊膜的病毒如HIV和辛德毕斯病毒(Sindbis virus,SbV)等,也是通过从细胞质膜上“出芽”的方式,组装与释放到细胞外(图3-5)。
二、膜脂
膜脂是生物膜的基本组成成分,每个动物细胞质膜上约有109个脂分子,即每平方微米的质膜上约有5×106个脂分子。膜脂不仅能帮助膜蛋白锚定在生物膜上,而且还影响到膜的形态特性和生物学功能。
(一)成分
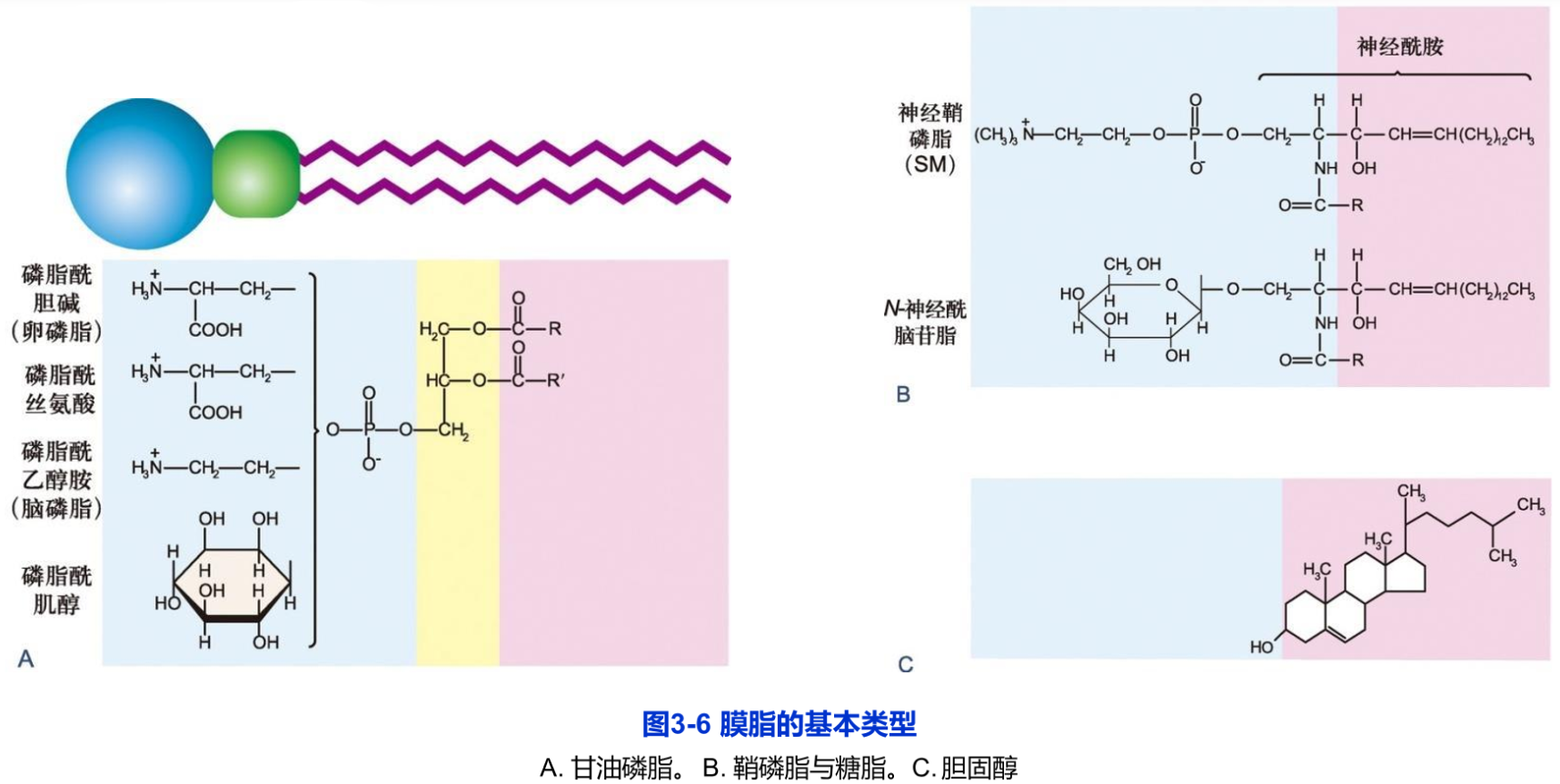
膜脂主要包括甘油磷脂(glycerophosphatide)、鞘脂(sphingolipid)和固醇(sterol)三种基本类型(图3-6)。它们的化学结构、在生物膜上的含量以及生物学功能各不相同。生物膜上还有少量的糖脂(glycolipid),鉴于绝大多数的糖脂都属于鞘氨醇的衍生物,因此,目前人们多将糖脂归于鞘脂类。
1.甘油磷脂
甘油磷脂构成了膜脂的基本成分,占整个膜脂的50%以上。甘油磷脂为3-磷酸甘油的衍生物,包括质膜中最丰富的磷脂酰胆碱(卵磷脂,phosphatidylcholine,PC)以及磷脂酰丝氨酸(phosphatidylserine,PS)、磷脂酰乙醇胺(phosphatidylethanolamine,PE)和磷脂酰肌醇(phosphatidylinositol,PI)等(图3-6A),主要在内质网合成。组成生物膜的甘油磷脂分子的主要特征是:
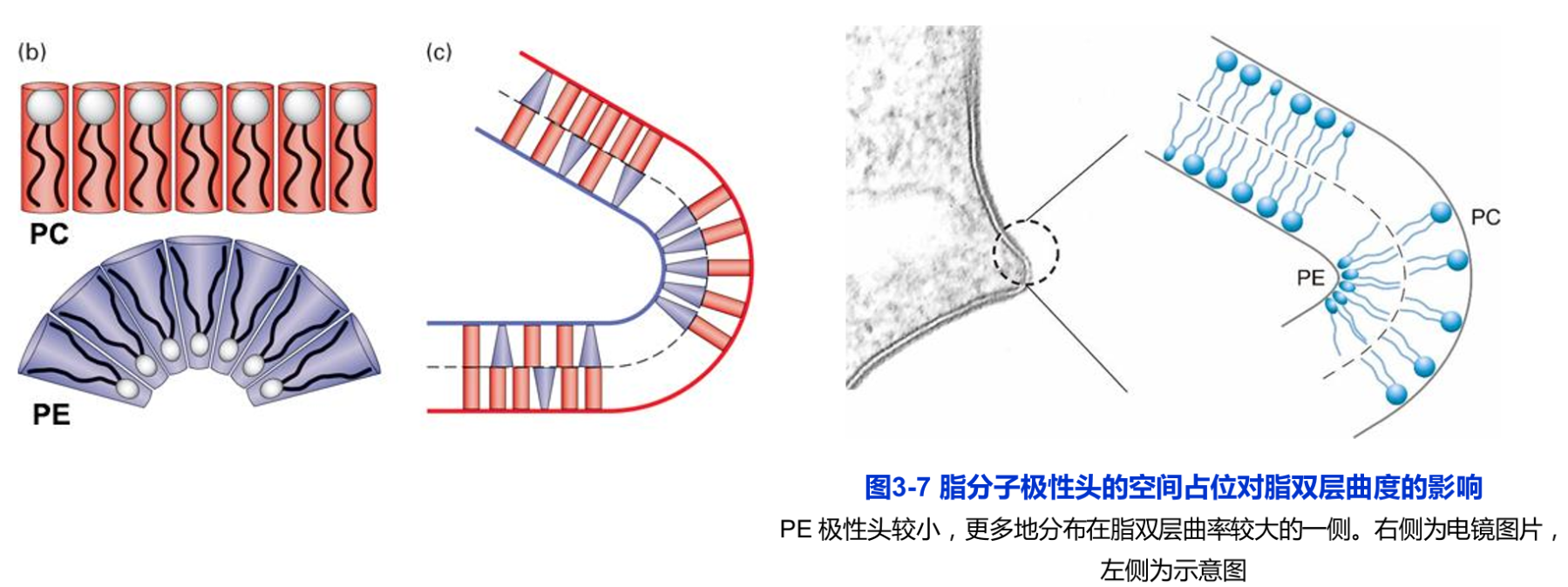
①具有一个与磷酸基团相结合的极性头和两个非极性的尾(脂肪酸链),但存在于线粒体内膜和某些细菌质膜上的心磷脂(cardiolipin)除外,它具有4个非极性的尾部;极性头的空间占位可影响脂双层的曲度(图3-7),如与PC比较,PE更倾向于形成曲面膜。
②脂肪酸碳链为偶数,多数碳链由16或18个碳原子组成。也有少量14或20个碳链组成的脂肪酸链。
③除饱和脂肪酸(如软脂酸、硬脂酸)外,常常还有含1~2个双键的不饱和脂肪酸(如油酸),不饱和脂肪酸多为顺式,顺式双键在烃链中产生约30°角的弯曲。
甘油磷脂不仅是生物膜的基本成分,而且其中的某些成分如P等在细胞信号转导中起重要作用。
2.鞘脂
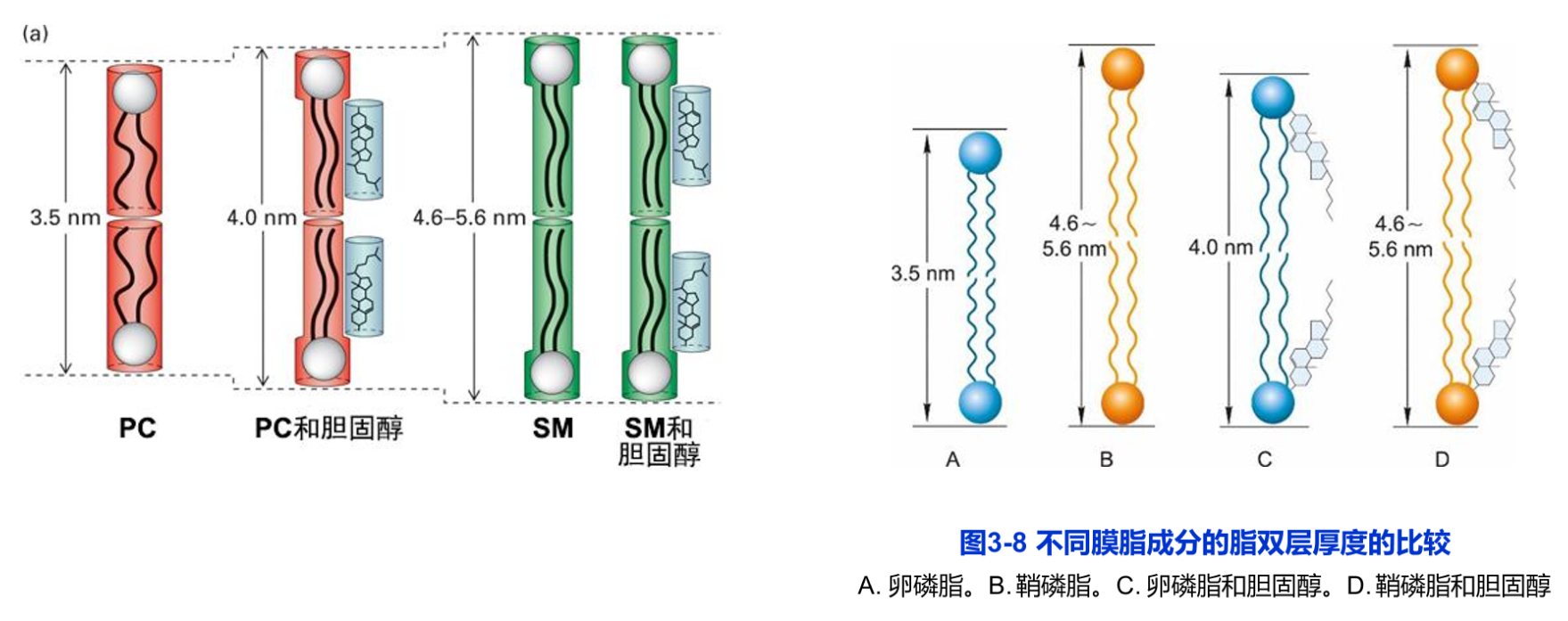
鞘脂均为鞘氨醇的衍生物,主要在高尔基体合成。它具有一条烃链,另一条链是与鞘氨醇的氨基共价结合的长链脂肪酸。其头部,可能是一个类似于甘油磷脂的基于磷酸基团的极性头部,称为鞘磷脂(sphingomyelin,SM),如神经鞘磷脂,是丰度最高的一种鞘磷脂,它的头部是一个与鞘氨醇分子末端的羟基共价结合的磷酸胆碱。其分子结构与甘油磷脂非常相似,因此统称磷脂(phospholipid)。鞘磷脂与甘油磷脂共同组成生物膜(图3-6B)。与鞘磷脂结合的脂肪酸链较长,可多达26个碳原子,因此鞘磷脂形成的脂双层的厚度较甘油磷脂的厚度更大,如SM为4.6~5.6nm,而PC约3.5nm(图3-8A、B)。
另一类鞘脂为糖脂,也是两性分子,它的极性头部是直接共价结合到鞘氨醇上的一个单糖分子或寡糖链,因此也称鞘糖脂。糖脂普遍存在于原核和真核细胞的细胞质膜上,其含量不足膜脂总量的5%,在神经细胞质膜上糖脂含量较高,占5%-10%。目前已发现40余种糖脂。不同的细胞中所含糖脂的种类不同,如神经细胞含有神经节苷脂,人红细胞表面含有ABO血型糖脂等,它们均具有重要的生物学功能。
在动物细胞中,最简单的糖脂是脑苷脂,因最早从人脑中提取故名,它们只有一个葡萄糖或半乳糖残基与鞘氨醇连接(图3-6B),较复杂的神经节苷脂可含多达7个糖残基,其中含有不同数目的唾液酸。糖脂不属于磷脂类。
3.固醇
胆固醇及其类似物统称固醇或甾醇,它是一类含有4个闭环的碳氢化合物,其亲水的头部为一个羟基,是一种分子刚性很强的两性化合物(图3-6C)。与磷脂不同的是其分子的特殊结构和疏水性太强,自身不能形成脂双层。只能插入磷脂分子之间,参与生物膜的形成。胆固醇与甘油磷脂相互作用会增加磷脂分子的有序性及脂双层的厚度,但对鞘磷脂没有明显的影响(图3-8C D)。胆固醇存在于动物细胞和极少数的原核细胞中,在哺乳动物的细胞质膜中,尤为丰富。其含量一般不超过膜脂的1/3。在多数的细胞中,50%~90%的胆固醇存在于细胞质膜和相关的囊泡膜上。胆固醇的合成是在动物细胞的胞质和内质网完成的,但动物体内胆固醇多数来自于食物。它在调节膜的流动性,增加膜的稳定性以及降低水溶性物质的通透性等方面都起着重要作用。同时,它又是脂筏的基本结构成分。缺乏胆固醇可能导致细胞分裂的抑制。植物细胞和真菌细胞中都有各自的固醇化合物,如植物中的豆固醇(stigmasterol)和真菌中的麦角固醇(ergosterol)。但它们的结构和合成途径与胆固醇稍有不同,这些微小差别正是目前使用的多数抗真菌药物的硏发基础。植物细胞质膜中的固醇含量高达膜脂总量的30%~50%,多数细菌质膜中不含有胆固醇成分,但某些细菌的膜脂中含有甘油脂等中性脂质。
胆固醇除了作为生物膜的主要结构成分外,还是很多重要的生物活性分子的前体化合物,如固醇类激素维生素D和胆酸等。人们还发现,胆固醇可以与发育调控的重要信号分子 Hedgehog共价结合此外在植物和多数微生物的细胞质膜中,会有大量的甘油糖脂,它是由二酰甘油分子中的羟基与糖基的糖苷键连接而成。在动物体内,甘油糖脂只存在于精子等少数细胞的质膜中。
膜脂作为生物膜的基本结构成分,其组成的分子类型对生物膜的结构和功能有很大的影响。实际上,细胞质膜和其他生物膜都具有各自特异的膜脂和膜蛋白成分。不同种类的细胞,同一细胞中不同类型的生物膜,甚至同一细胞的质膜的不同部位,其膜的组分也可能有明显的差别,因此膜的厚度也是不均一的,且处于动态变化之中。如高尔基体膜上的鞘磷脂的含量为内质网膜的6倍,小肠上皮细胞腔面质膜中的鞘磷脂含量是质膜其他部位含量的2倍,后者显然有助于增加腔面质膜的稳定性。
(二)膜脂的运动方式
膜脂分子有4种运动方式:
(1)沿膜平面的侧向运动,温度为37℃时的扩散系数为10-8cm2/s,相当于每秒移动2μm的距离。由于侧向运动产生分子间的换位,其交换频率约10次/s。磷脂分子通过侧向运动从细菌的一端到另一端一般仅需要1s,动物细胞大约20s。侧向运动是膜脂分子的基本运动方式,具有重要的生物学意义。
(2)脂分子围绕轴心的自旋运动。
(3)脂分子尾部的摆动。脂肪酸链靠近极性头部的摆动较小,其尾部摆动较大。X射线衍射分析显示,在距头部第9个碳原子以后的脂肪酸链已变成无序状态。
(4)双层脂分子之间的翻转运动:一般情况下翻转运动极少发生,其发生频率还不到脂分子侧向交换频率的百亿分之一。研究人工膜上脂分子运动所得到的结果与用支原体、细菌和红细胞膜为材料所得到的结果类似但脂分子的翻转运动在细胞某些膜系统中发生的频率很高,特别是在内质网膜上,新合成的磷脂分子经几分钟后,将有半数从脂双层的一个小叶通过翻转运动转位到另一个小叶,为自然翻转运动速率的10万倍。但这过程需要特殊的膜蛋白称翻转酶(flippase)来完成。
分子的运动不仅与脂分子的类型有关,也与脂分子同膜蛋白及膜两侧的生物大分子之间的相互作用以及温度等环境因素有关。因此,在某一特定的细胞中所检测到的某类脂分子的运动速率,可能与人工脂膜的数据有较大的差别。
(三)脂质体
指质体(liposome)是根据磷脂分子可在水相中形成稳定的脂双层膜的现象而制备的人工膜。单层脂分子铺展在水面上时,其极性端插入水相而非极性尾部面向空气界面,搅动后形成乳浊液,即形成极性端向外而非极性端在内的脂分子团又称微团(mcel),或形成双层脂分子的球形脂质体(图3-9A、C)。天然磷脂有两条非极性尾部,难以形成微团,当用磷脂酶处理,仅保留一条脂肪酸链时,就很容易形成微团,我们在用肥皂洗手时的滑润感主要源于液体中大量的微团球形脂质体直径为25-1000m不等,控制形成条件可获得大小均一的脂质体,同样的原理还可以制备平面的脂质体膜,但需要有固体支撑物(图3-9B)。
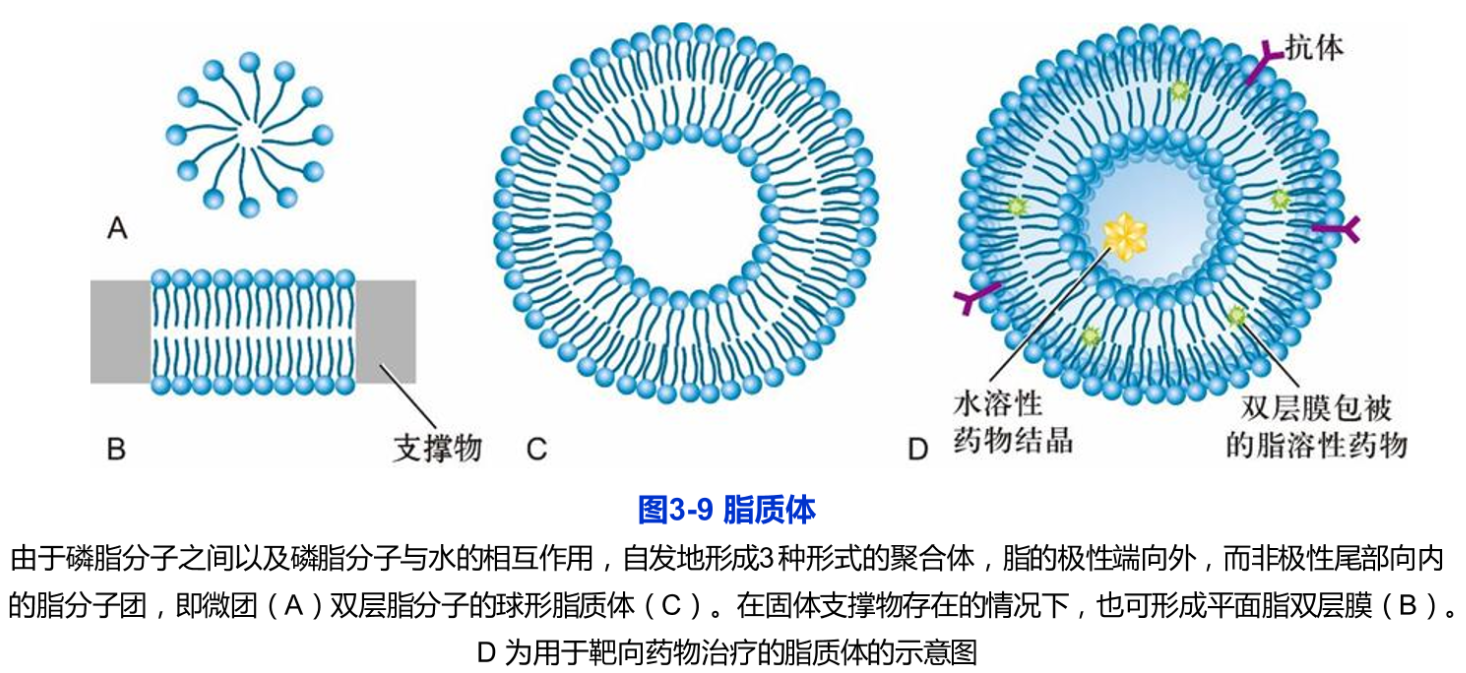
脂质体可用单一或混合的磷脂来制备,同时还可以嵌入不同的膜蛋白,因此脂质体是研究膜脂与膜蛋白及其生物学性质的极好实验材料。脂质体中裹入DNA可有效地将其导入细胞中,因此常用于转基因实验。在临床治疗中,脂质体显示出诱人的应用前景。脂质体中裹入不同的药物或酶等具有特殊功能的生物大分子,可望用于治疗多种疾病。特别是脂质体技术与单克隆抗体及其他技术结合,可使药物更有效地作用于靶细胞以减少对机体的损伤(图3-9D)。
三、膜蛋白
膜蛋白是位于脂双层之中或表面的蛋白质总称。动物细胞主要有9种膜脂,而膜蛋白的种类繁多。酵母基因组中约1乃3的基因编码膜蛋白,多细胞有机体膜蛋白的种类更多一些。虽然多数膜蛋白的分子数量较少,但却赋予生物膜非常重要的生物学功能。50%以上的小分子药物的受体为膜蛋白。不同类型的细胞以及细胞不同部位的生物膜,其膜蛋白的含量与种类都有很大的区别。如线粒体内膜的膜蛋白含量达76%,而在神经细胞髓鞘质膜中,仅占18%。膜蛋白赋予各种生物膜行使不同的生理功能。
(一)膜蛋白的类型
根据膜蛋白分离的难易程度及其与脂分子的结合方式,膜蛋白可分为三种基本类型:周边膜蛋白(peripheral membrane protein)或称外在膜蛋白(extrinsic membrane protein)、整合膜蛋白(integral membrane protein)或称内在膜蛋白(intrinsic membrane protein)和脂锚定膜蛋白(lipid- anchored membrane protein)(图3-10)。
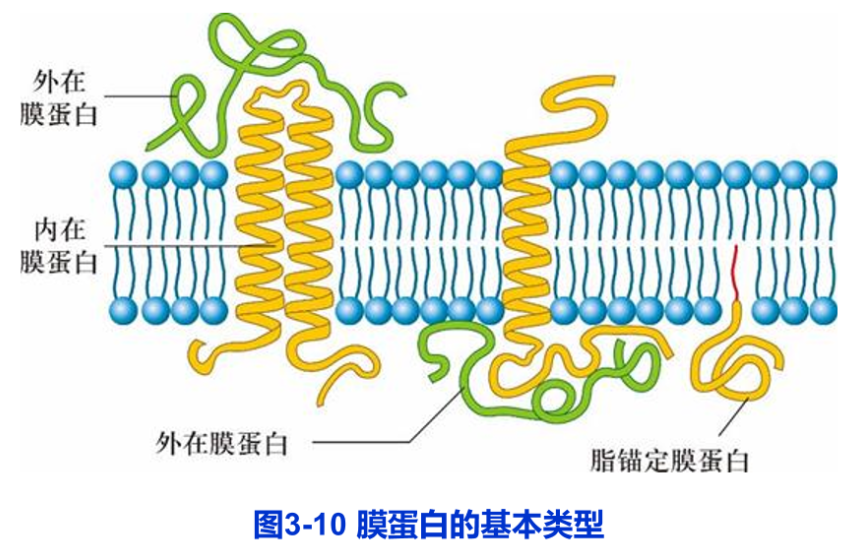
周边膜蛋白为水溶性蛋白质,它不直接与脂双层的疏水核心接触,而是靠离子键或其他较弱的键与膜表面的膜蛋白分子或膜脂分子结合,因此只要改变溶液的离子强度甚至提高温度就可以从膜上分离下来,但膜结构并不被破坏。如多种以磷脂为底物的水溶性酶类,就是通过其分子中特殊部位结合到生物膜表面。磷脂酶(phospholipase)是其中一例,它以较高的亲和力结合到膜界面的磷脂头部极性基团上,以降解衰老或损伤的生物膜,它也是多种蛇毒的活性成分。
脂锚定膜蛋白是通过与之共价相连的脂分子(脂肪酸或糖脂)插入膜的脂双分子中,而锚定在细胞质膜上,其水溶性的蛋白质部分位于脂双层外。脂锚定膜蛋白可分三种类型(图3-11):
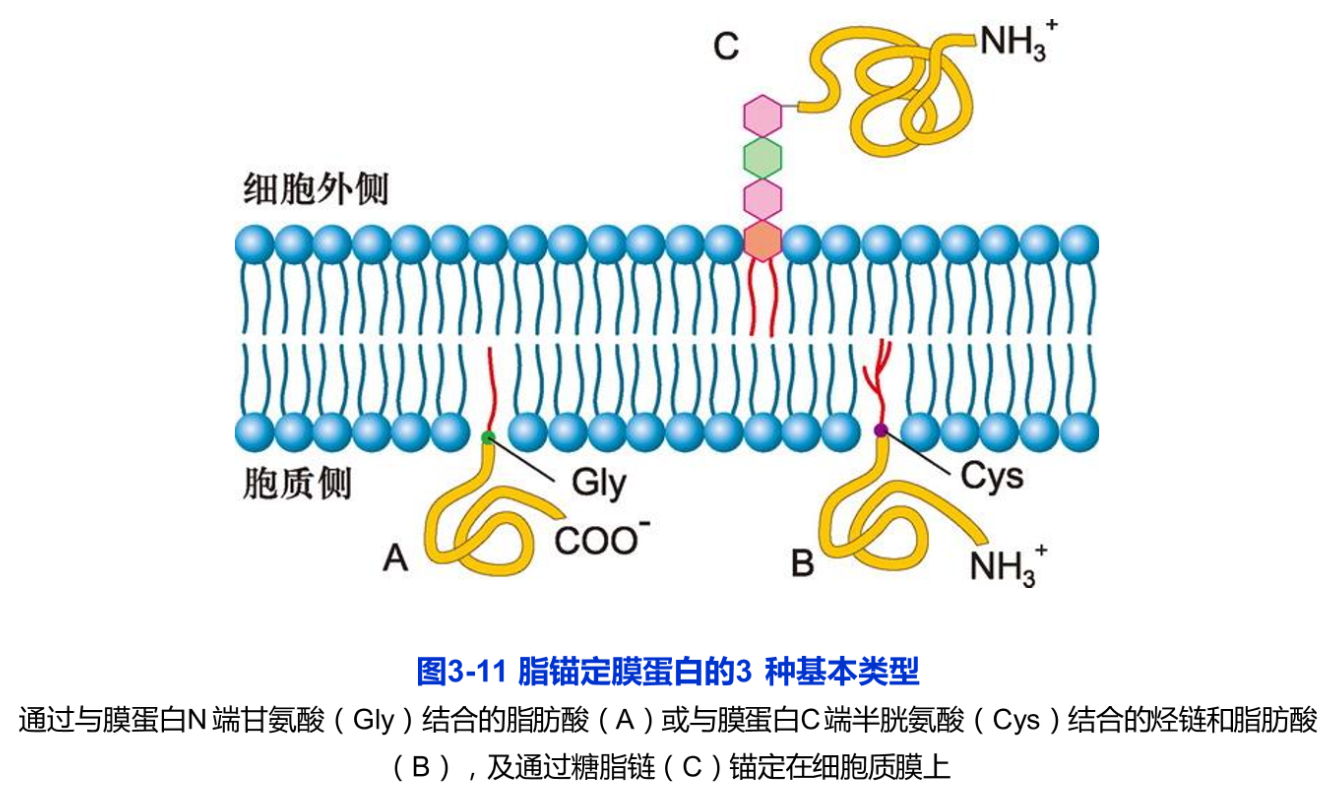
(1)脂肪酸(豆蔻酸或软脂酸等)结合到膜蛋白N端的甘氨酸残基上(图3-11A)。如与肿瘤发生相关的酪氨酸蛋白激酶的突变体v-Src,就是通过与其N端共价结合的豆蔻酸插入脂双层的细胞质小叶。它是人们发现的第一个病毒癌基因产物。
(2)由15或20个碳链长的烃链结合到膜蛋白C端的半胱氨酸残基上(图3-11B),有时还有另一条烃链或脂肪酸链结合到近C端的其他半胱氨酸残基上,这种双重锚定有助于蛋白质更牢固地与膜脂结合。例如同属于GTP酶超家族的Ras和Rab蛋白均为双锚定膜蛋白。前者参与细胞信号转导,后者介导膜泡的融合。上述两类脂锚定膜蛋白均分布在细胞质膜的细胞质一侧。
(3)通过糖脂锚定在细胞质膜上(图3-11C)。如磷脂酶C和大分子的蛋白聚糖(proteoglycan)。在不同的细胞中,这类糖脂的结构有很大的不同,但都含有磷脂酰肌醇(PI)基团,因此称为磷脂酰肌醇糖脂(glycosylphosphatidylinositol,GPI)锚定方式,简称GPI锚定方式。与磷脂分子类似,同磷脂酰肌醇结合的2个脂肪酸链插入脂膜中。肌醇同时与长度不等的寡糖链相结合,最后寡糖末端的磷酸己醇胺与蛋白质共价相连,从而有效地将蛋白质结合到质膜上。GPI脂锚定膜蛋白都分布在质膜外侧。
整合膜蛋白与膜结合比较紧密,只有用去垢剂处理使膜崩解后才可分离出来。整合膜蛋白占整个膜蛋白的70%~80%,据估计人类基因中,14~1/3基因编码的蛋白质为整合膜蛋白。
(二)整合膜蛋白与膜脂结合的方式
目前所了解的整合膜蛋白均为跨膜蛋白(trans membrane protein),跨膜蛋白在结构上可分为:胞质外结构域、跨膜结构域和胞质内结构域等三个组成部分(图3-12)。它与膜结合的主要方式有:
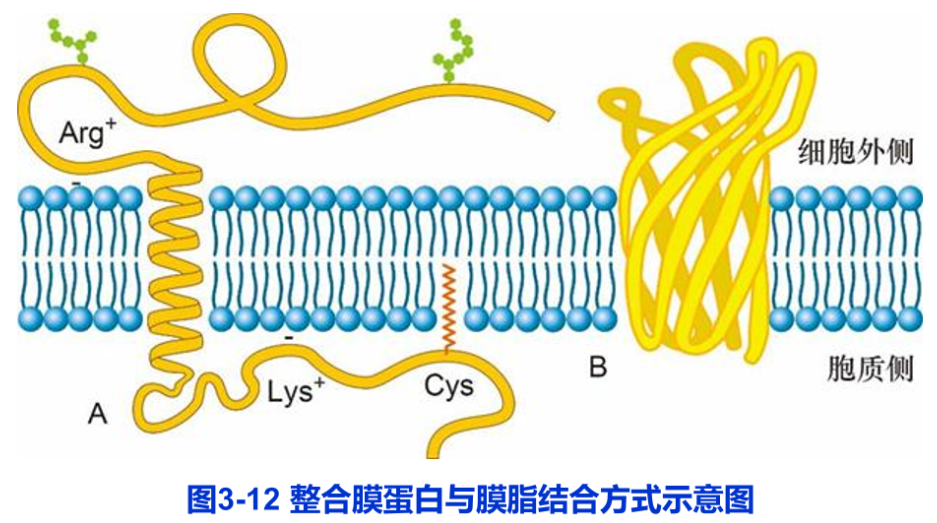
(1)膜蛋白的跨膜结构域与脂双层分子的疏水核心的相互作用,这是整合膜蛋白与膜脂结合的最主要和最基本的结合方式。
(2)跨膜结构域两端携带正电荷的氨基酸残基,如精氨酸、赖氨酸等与磷脂分子带负电的极性头部形成离子键,或带负电的氨基酸残基通过Ca2+、Mg2+等阳离子与带负电的磷脂极性头部相互作用。
(3)某些膜蛋白通过自身在胞质一侧的半胱氨酸残基共价结合到脂肪酸分子上,后者插入脂双层中进一步加强膜蛋白与脂双层的结合力。
整合膜蛋白的跨膜结构域是与膜脂结合的主要部位,具体作用方式如下:
(1)跨膜结构域含有20个左右的疏水氨基酸残基,形成α螺旋(长度约3nm),其外侧疏水侧链通过范德华力与脂双层分子脂肪酸链(厚度约3.2nm)相互作用(图3-12A)。这类膜蛋白称单次跨膜蛋白(single-pass transmembrane protein),如红细胞质膜上的血型糖蛋白A( glycophorin A),其跨膜的α螺旋由23个氨基酸残基组成。多数膜蛋白具有几个跨膜的α螺旋区,称多次跨膜蛋白(multipass transmembrane protein)。如在细胞信
号转导通路中,最普遍存在的G蛋白偶联信号通路的细胞表面受体就是一类跨膜7次的膜蛋白。跨膜结构域的α螺旋的方向,有的与膜面垂直,有的则与膜面呈一定的角度。因此跨膜结构域的α螺旋的长度也各有差异。
(2)跨膜结构域主要由β折叠片(图3-12B)组成,如大肠杆菌外膜上的孔蛋白(porn)以及线粒体、叶绿体外膜上的孔蛋白。由于α螺旋中相邻两个氨基酸残基的轴向距离为0.15m,而在β折叠片中为0.35nm。所以跨膜结构域的β折叠片一般由10~12个氨基酸残基组成,就足以跨越细胞膜。X射线晶体学研究结果显示,大肠杆菌的孔蛋白OmpX由三聚体组成,在每一个亚基中,16个反向平行的β折叠片相互作用形成跨膜通道,通道具有疏水性的外侧和亲水性的内侧。细菌中发现了多种类型的孔蛋白,用于不同的物质转运和多种其他的生物学功能,但在线粒体和叶绿体中,孔蛋白类型较少,可允许分子量小于104的小分子自由通过。孔蛋白跨膜结构域疏水性的外侧以及某些疏水性的侧链,使其稳定地结合在脂膜上。
(3)某些α螺旋既具有极性侧链又具有非极性侧链。多个α螺旋形成特异极性分子的跨膜通道,其外侧是非极性链,与膜脂相互作用;内侧是极性链,形成通道。如人红细胞膜上的带3(band3)蛋白,它介导HCO的跨膜运输。
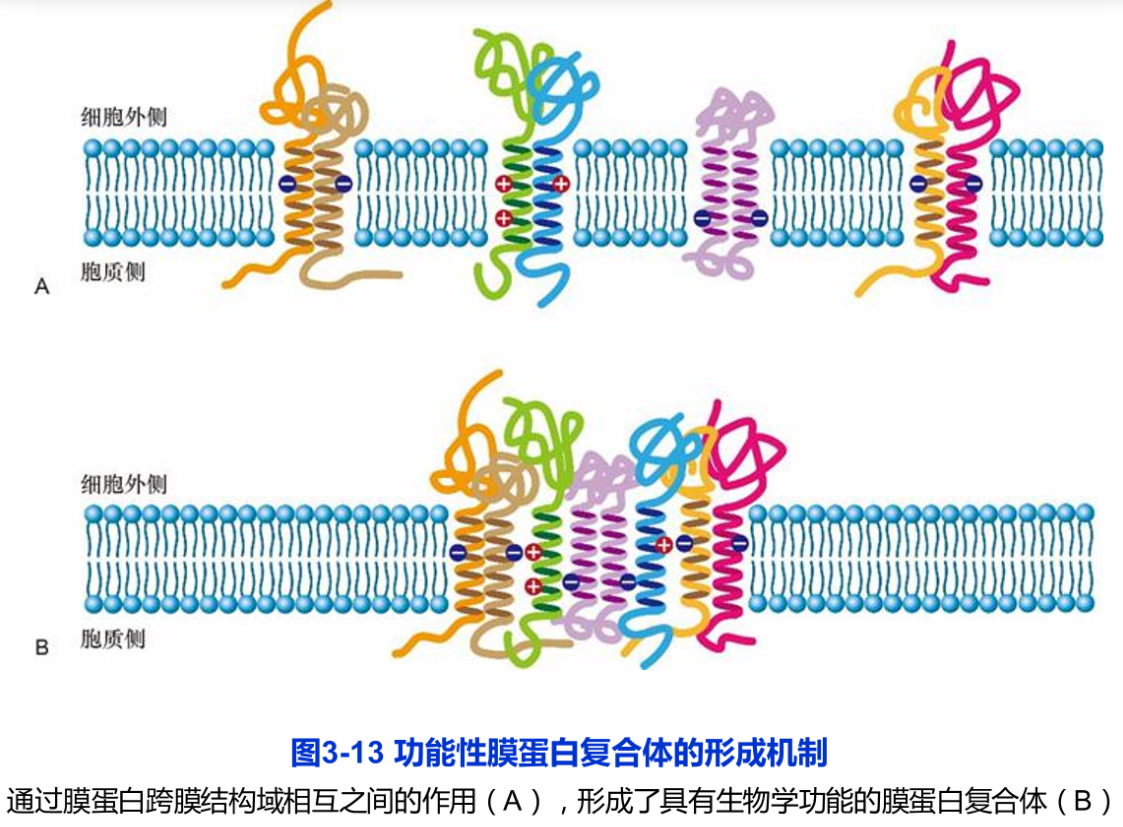
结构分析的结果显示,跨膜蛋白与膜脂的相互作用往往是非常复杂的。首先,跨膜蛋白的跨膜结构域本身就各不相同(如外侧的疏水氨基酸侧链),跨膜结构域的轴向与脂膜平面的角度不同,再加上很多膜蛋白是以三聚体甚至多聚体的方式行使其功能。这又涉及跨膜结构域之间相互作用,如血型糖蛋白A二聚体是通过两个跨膜结构域形成的卷曲结构(coiled-coil)。由4个二聚体组成的T细胞抗原受体是通过膜蛋白跨膜结构域α螺旋所携带的正、负电荷相互吸引,最终疏水跨膜片段及其与脂类的相互作用组装成有功能的多聚体(图3-13)。
水孔蛋白(aquaporin)是一类具有6个a螺旋区的蛋白质家族,通常形成四聚体的膜蛋白以行使其转运水或甘油等分子的功能。Glpf是其中一种转运甘油的水孔蛋白(图3-14)。
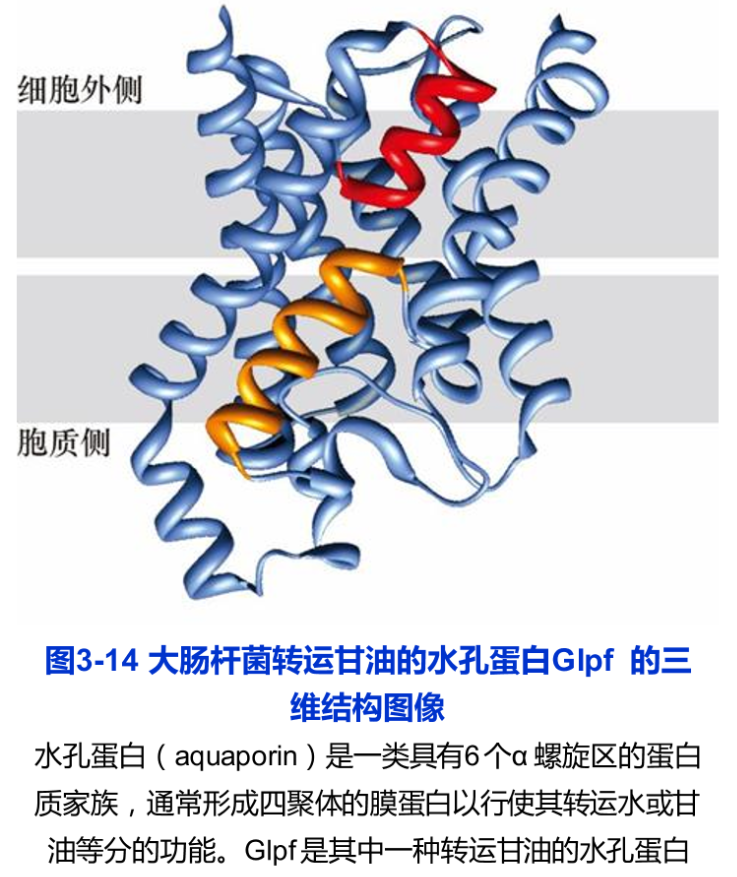
用X射线衍射技术获得的三维结构的图像显示了膜蛋白与膜脂的复杂结合方式,多数跨膜α螺旋的方向与脂膜平面成一定角度,一条最长的a螺旋在中部出现弯曲,特别是有两条较短的α螺旋其N端相对,各插进脂膜的一半(图3-14)。可以想象,膜脂的种类和与膜蛋白的作用方式也直接影响到膜蛋白的空间构象及其功能。已知水孔蛋白0(aquaporin-0,AQPO)在脂膜中,周围排列紧密的磷脂面对跨膜结构域的疏水部分,脂肪酸链呈直线排列,而面对某些亲水的表面,脂肪酸链呈扭曲状。某些磷脂分子的头部基团与膜面平行,而某些磷脂分子的头部基团则与膜面近于垂直。又如,线粒体内膜中心的磷脂与氧化磷酸化相关的膜蛋白复合体的相互作用,可能对其稳定性是十分重要的。这些都显示了膜脂与膜蛋白的特异的复杂的相互作用。虽然,人们可以根据膜蛋白分子的氨基酸序列推测其三级结构,但对膜蛋白及其与膜脂关系的三维结构的分析,对深入了解其结构和功能依然是至关重要的研究课题。
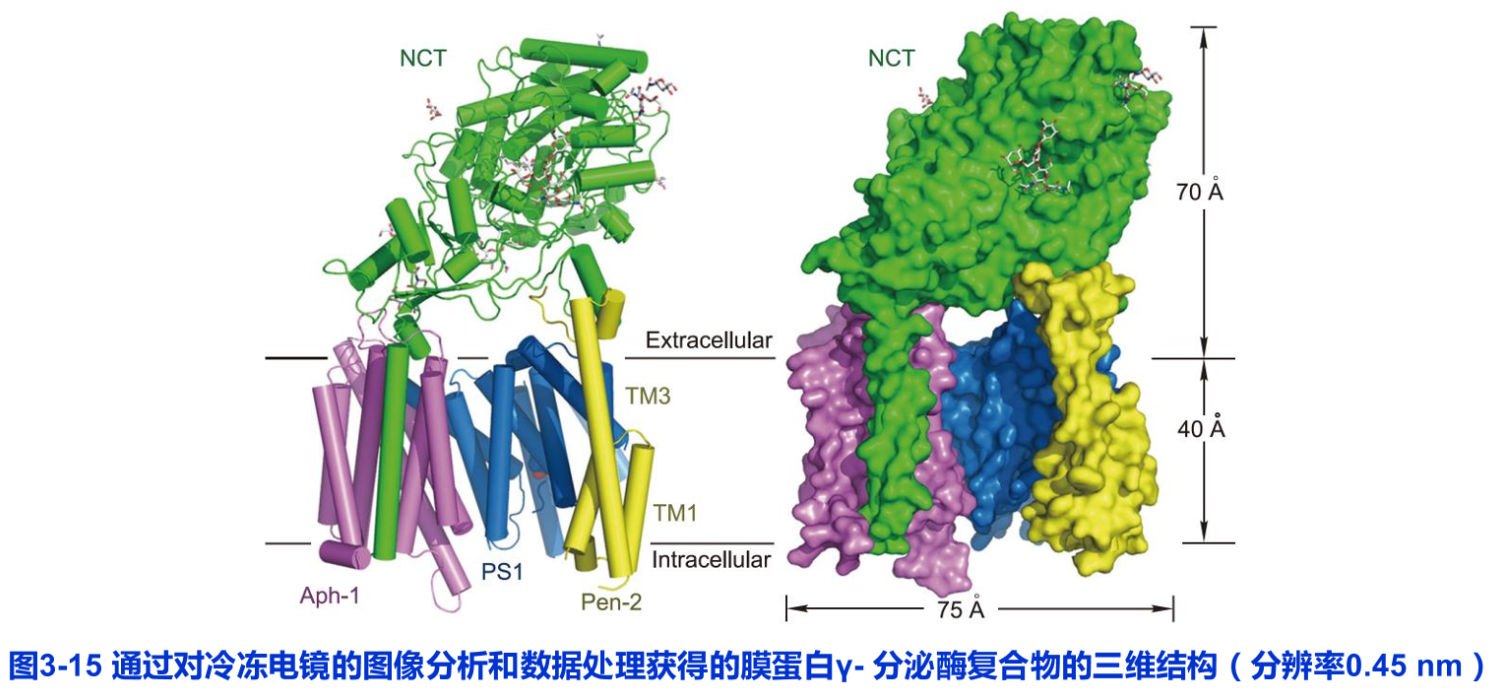
在过去的几十年中,虽然已克隆了几千种膜蛋白的基因,但由于其难以形成晶体,因而只对几百种膜蛋白的结构获得了高分辨率的解析结果。其三维结构分析主要是应用X射线晶体衍射技术。我国学者也曾成功地解析了叶绿体膜上的捕光复合物Ⅱ的晶体结构、线粒体内膜电子传递链上的复合物Ⅱ和葡糖转运蛋白(见图4-5)等晶体结构,使得对这类多亚基膜蛋白复合体的结构与功能的研究取得了重要成果。特别是2013年以来,低温电镜单颗粒分析技术的革命性进展(见第二章),其三维结构图像分辨率接近原子尺度,这无疑极大地促进了对难以结晶的膜蛋白结构的解析。施一公等应用低温电镜单颗粒分析技术,获得了神经细胞质膜上的膜蛋白—Y分泌酶复合体高分辨三维结构图像(图3-15),就是一个很好的实例,它为了解阿尔茨海默病的发病机制与治疗提供了重要的理论依据。
(三)去垢剂
去垢剂(detergent)是一端亲水端疏水的两性小分子,是分离与研究膜蛋白的常用试剂。去垢剂可以插入膜脂,与膜脂或膜蛋白的跨膜结构域等疏水部位结合,形成可溶性的微粒(图3-16A)。
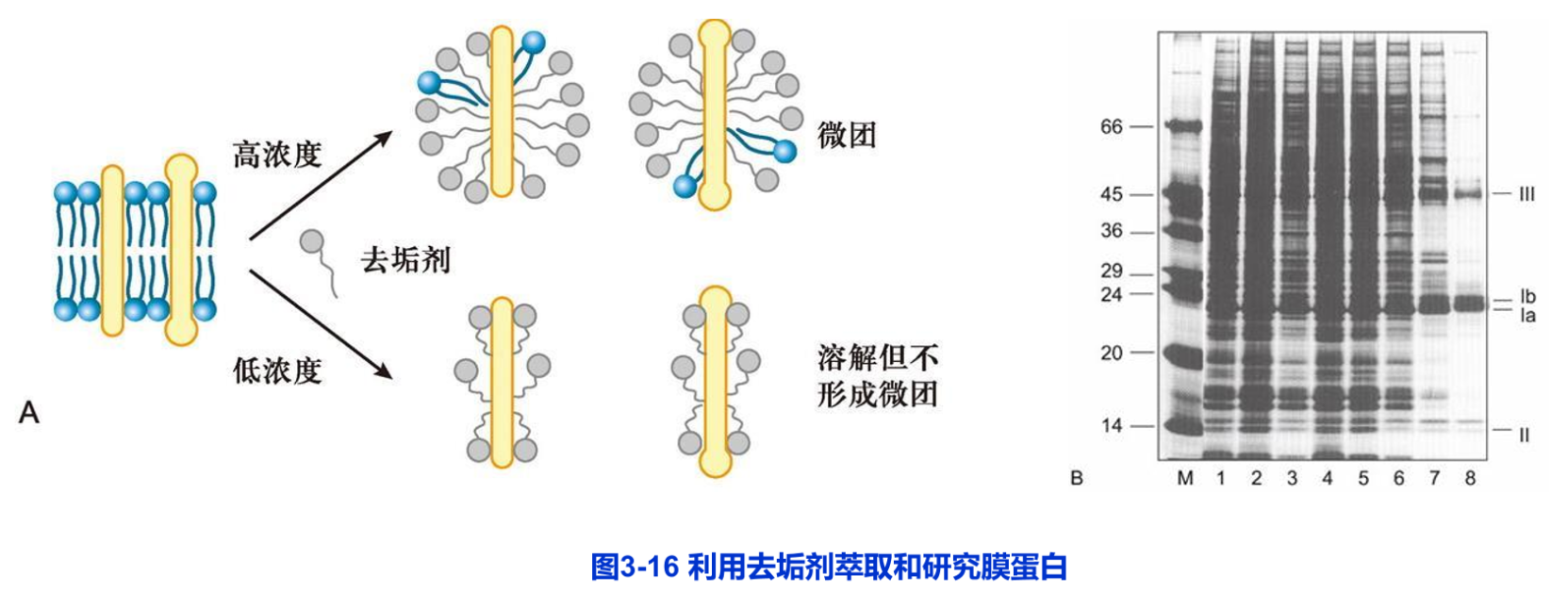
少量的去垢剂能以单分子状态溶解于水中,当达到一定浓度时,去垢剂分子可在水中形成微团(micelle),此时去垢剂的浓度称为微团临界浓度(critical micelle concentration,CMC)。CMC是各种去垢剂的特征和功能的重要参数。当使用的去垢剂的浓度高于或底于其CMC时,去垢剂的作用方式和膜蛋白的分离效果均有所不同。去垢剂分为离子型去垢剂和非离子型去垢剂两种类型。
常用的离子型去垢剂如十二烷基硫酸钠(SDS)具有带电荷的基团,其分子式如下:
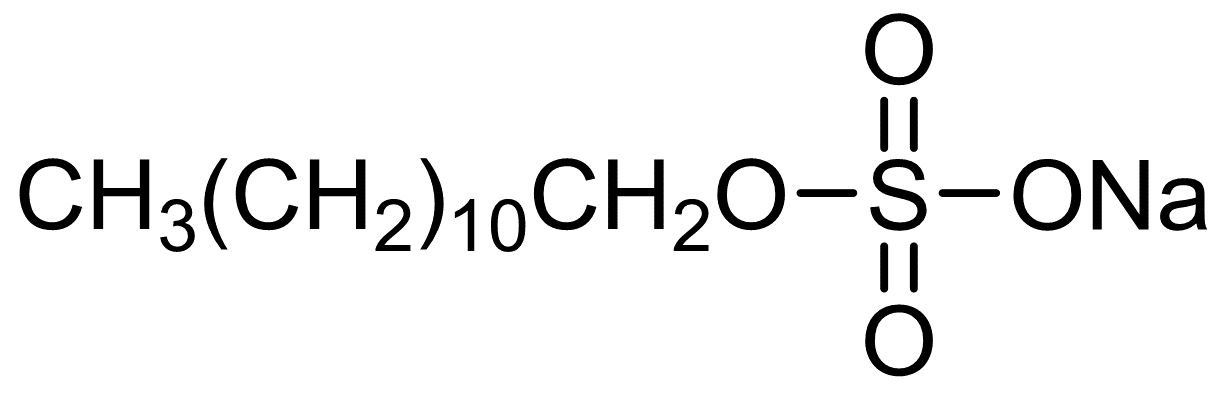
SDS可使细胞膜崩解,与膜蛋白疏水部分结合并使其与膜分离,高浓度的SDS还可以破坏蛋白质中的离子键和氢键等非共价键,甚至改变蛋白质亲水部分的构象。这一特性常用于蛋白质成分分析的SDS凝胶电泳。
由于SDS对蛋白质的作用较为剧烈,可引起蛋白质变性,因此在纯化膜蛋白时,特别是为获得有生物活性的膜蛋白时,常采用不带电荷的非离子去垢剂。
常用的非离子型去垢剂 Triton X-100(商品名)分子式如下:
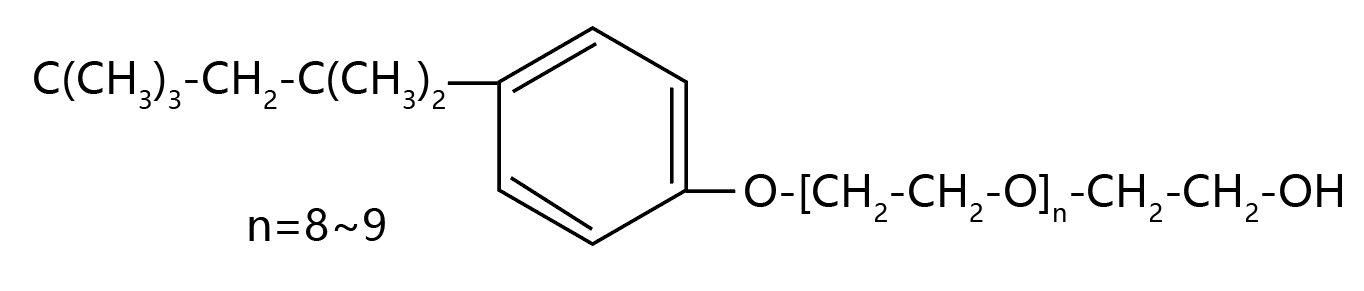
非离子去垢剂也可使细胞膜崩解,但对蛋白质的作用比较温和,它不仅用于膜蛋白的分离与纯化,也用于除去细胞的膜系统,以便对细胞骨架蛋白和其他蛋白质进行研究。
去垢剂有多种类型,多数为人工合成。由于不同的去垢剂对各种膜蛋白的作用有所区别,因此,有针对性地选用合适的定浓度的去垢剂在膜蛋白的分离与纯化过程中,就显得尤为重要(图3-16B)。


