第一节 膜转运蛋白与小分子及离子的跨膜运输
一、膜转运蛋白
活细胞内外的离子浓度是高度不同的,Na+是细胞外最丰富的阳离子(cation),而K是细胞内最丰富的阳离子(表4-1)。细胞内外的离子浓度差异对于细胞的存活和功能至关重要。这种离子浓度差异分布主要由两种机制所调控:一是取决于一套特殊的膜转运蛋自(membrane transport protein)的活性;二是取决于质膜本身的脂双层所具有的疏水性特征。除了脂溶性分子和小的不带电荷的分子能以简单扩散的方式直接通过脂双层外,脂双层对绝大多数极性分子、离子以及细胞代谢产物的通透性都极低,形成了细胞的渗透屏障。这些物质的跨膜转运需要质膜上的膜转运蛋白参与。转运蛋白在细胞营养物摄取、代谢产物释放以及信号跨膜转换等生命活动中起重要作用。不少疾病都与膜转运蛋白的功能失常有关。
各种细胞膜结合蛋白中,约15%~30%是膜转运蛋白。膜转运蛋白可分为两大类:一类是载体蛋白(carrier protein,transporter);另一类是通道蛋白(channel protein)。有些载体蛋白介导主动运输,有些介导协助扩散,而通道蛋白只介导协助扩散。
(一)载体蛋白及其功能
载体蛋白几乎存在于所有类型的生物膜上,属于多次跨膜蛋白。每种载体蛋白能与特定的溶质结合,通过系列构象改变介导溶质的跨膜转运(图4-1)。20世纪50年代中期,在细菌中发现单基因突变可导致半乳糖跨膜运输被阻断,从而发现了细菌质膜上负责β一半乳糖转运的载体蛋白。类似的基因突变在人的胱氨酸尿(cystinuria)遗传病患者中发现,这种病人的肾细胞和肠细胞不能将胱氨酸和半胱氨酸转运到血液,从而导致这些氨基酸在尿中积累并在肾中形成胱氨酸结石。
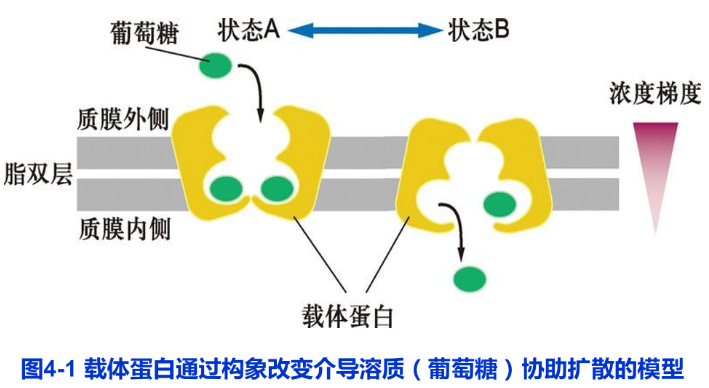
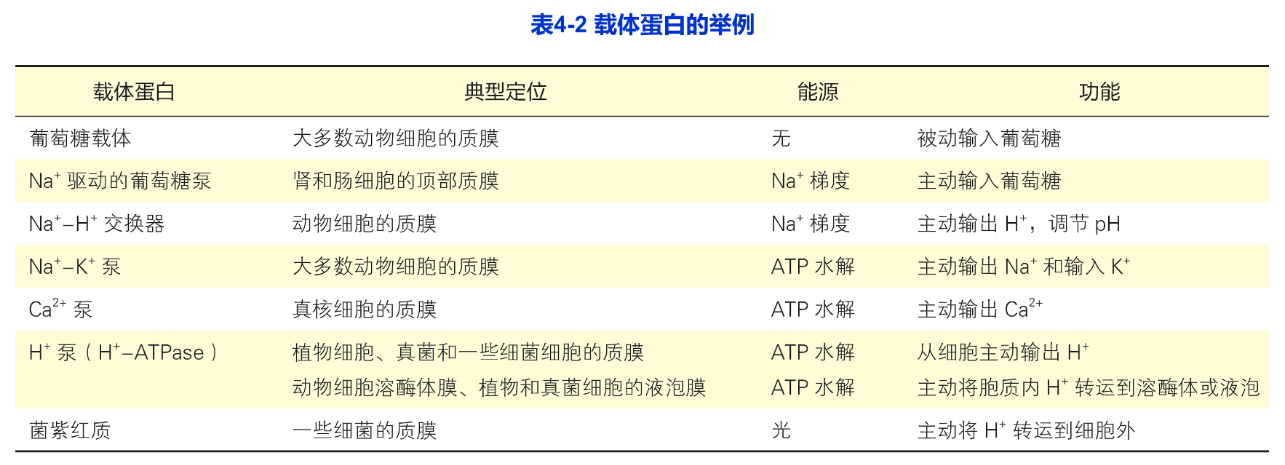
不同的生物膜往往含有各自功能相关的不同载体蛋白(表4-2),质膜具有输入营养物糖、氨基酸和核苷酸的载体蛋白。线粒体内膜具有输入丙酮酸和ADP以及输出ATP的载体蛋白等。载体蛋白与酶类似:具有与溶质(底物)特异性结合的位点,所以每种载体蛋白对溶质具有高度选择性;转运过程具有类似于酶与底物作用的饱和动力学特征:既可被底物类似物竞争性地抑制,又可被某种抑制剂非竞争性抑制以及对pH有依赖性等。因此,有人将载体蛋白称为通透酶(permease)与酶不同的是,载体蛋白对转运的溶质不作任何共价修饰。
(二)通道蛋白及其功能
目前发现的通道蛋白有上百种,普遍存在于各类真核细胞的质膜以及细胞内膜上。通道蛋白通过形成亲水性通道,实现对特异溶质的跨膜转运,有三种类型:离子通道(ion channel)、孔蛋白(porn)以及水孔蛋白(aquaporin,AQP)。目前所发现的大多数通道蛋白都是离子通道。
离子通道蛋白通常形成选择性和门控性跨膜通道。因为对离子的选择性取决于通道的直径、形状以及通道内带电荷氨基酸残基的分布,所以离子通道介导协助扩散时不需要与溶质结合,只有大小和电荷适宜的离子才能通过。孔蛋白存在于革兰氏阴性细菌的外膜以及线粒体和叶绿体的外膜上,其跨膜区域由β折叠片层形成柱状亲水性通道。与离子通道蛋白相比,孔蛋白选择性很低,而且能通过较大的分子,如线粒体外膜上的孔蛋白可允许分子量为5000的分子通过。水孔蛋白是近年来发现的一类新的通道蛋白,其转运机制随后介绍。
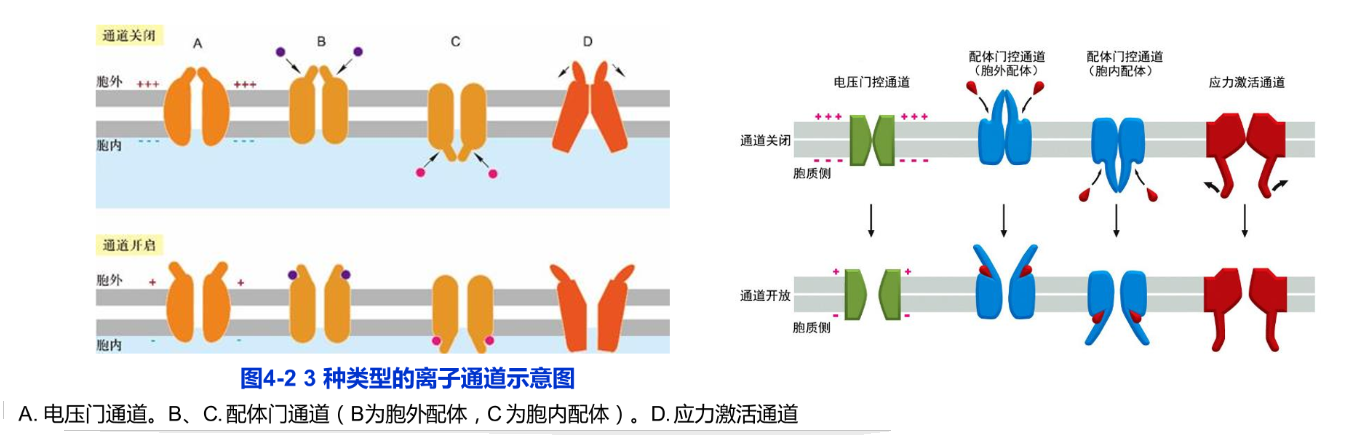
根据对离子通道的研究,发现与载体蛋白相比,离子通道具有两个显著特征:第一个特征是具有极高的转运速率,比已知任何一种载体蛋白最快转运速率要高1000倍以上,每个通道每秒钟可通过107~108个离子,接近自由扩散的理论值。驱动离子跨膜转运的动力来自溶质的浓度梯度和跨膜电位差两种力的合力,即跨膜的电化学梯度(electrochemical gradient),运输的方向顺电化学梯度进行。第二个特征是离子通道并非连续性开放而是门控的,即通道的开启或关闭受膜电位变化、化学信号或压力刺激的调控。因此,根据激活信号的不同,离子通道可分为电压门控通道(voltage-gated channel)、配体门控通道(ligand-gated channel)和应力激活通道(stress-activated channel)(图4-2)。在电压门控通道中,带电荷的蛋白质结构域会随跨膜电位梯度的改变而发生相应的移动,从而使离子通道开启或关闭。在配体门控通道中,细胞内外的某些小分子配体与通道蛋白结合后引起通道开启或关闭。应力激活通道是通道蛋白感受应力而开启通道形成离子流,产生电信号。内耳听觉毛细胞就是依赖于这类通道的典型例子。离子通道决定了细胞膜对于特定离子的通透性,并与离子泵(如Na+-K+泵)一起,调节细胞内的离子浓度和跨膜电位。神经细胞离子通道的迅速激活导致动作电位的产生和传递;肌细胞中肌质网膜Ca2+通道的迅速开启使得储存的Ca2+释放到细胞质基质,从而引发肌肉的收缩。
二、小分子及离子的跨膜运输类型
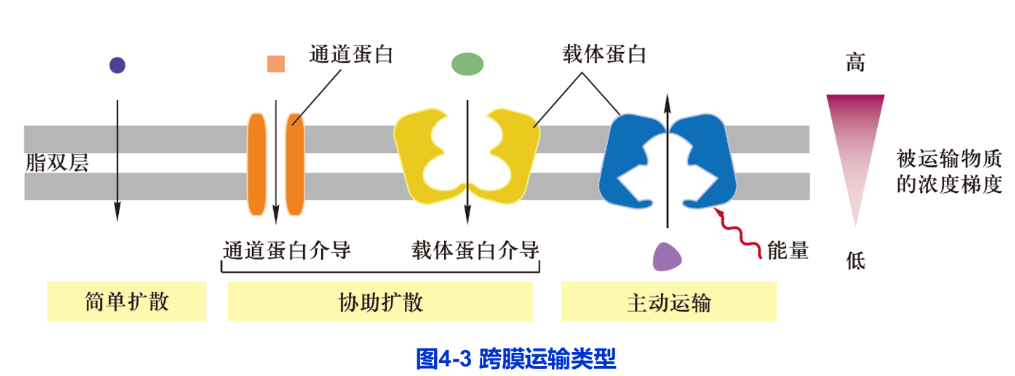
小分子或离子的跨膜运输与诸多生物学过程密切相关,如神经细胞的可兴奋性传递、细胞对营养物的摄取、细胞信号转导、细胞渗透压的维持以及细量转换中ATP的产生等。根据跨膜转运是否需要细胞提供能量,跨膜运输分为两种类型:被动运输(passive transport)和主动运输(active transport)。被动运输中又根据是否需要膜转运蛋白参与,分为两种类型:简单扩散(simple diffusion)和协助扩散(facilitated diffusion)(图4-3)。
(一)简单扩散
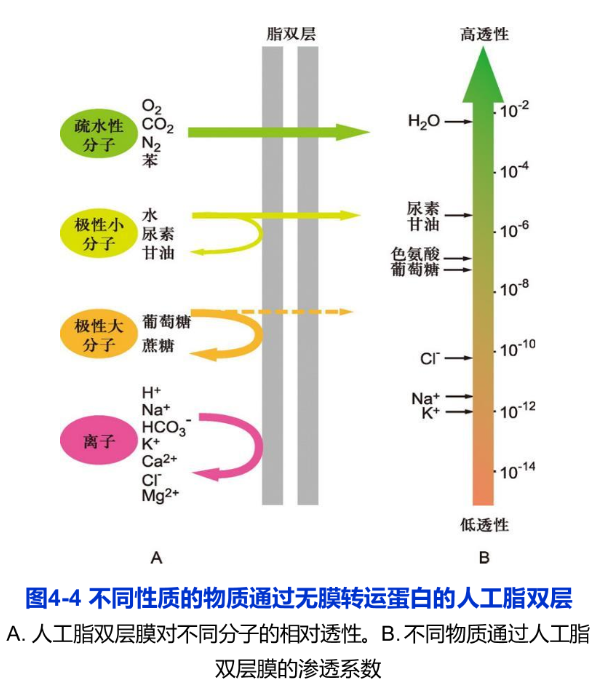
小分子或离子以热自由运动的方式顺着电化学梯度或浓度梯度直接通过脂双层进出细胞,不需要细胞提供能量,也无需膜转运蛋白的协助,称为简单扩散。不同性质的小分子及离子跨膜运动的速率差异极大。疏水性小分子如O2、N2以及不带电荷的极性小分子很容易通过简单扩散进出细胞。在简单扩散的跨膜运动中,脂双层对溶质的通透性大小主要取决于分子大小和极性。小分子比大分子更容易跨膜,非极性分子比极性分子更容易跨膜,而带电荷的离子跨膜运动则需要更高的自由能,所以没有膜转运蛋白的人工脂双层对离子是高度不透的。图4-4显示在通过无膜转运蛋白的人工脂双层时,不同性质的小分子或离子具有不同的跨膜运动速率。
物质对膜的通透性(P)可以根据它在油和水中的分配系数(K)及其扩散系数(D)来计算
P=KD/t
式中,t为膜的厚度。
(二)协助扩散
协助扩散是指溶质顺着电化学梯度或浓度梯度,在膜转运蛋白协助下的跨膜转运方式,又叫易化扩散。协助扩散不需要细胞提供代谢能量,转运的动力来自物质的电化学梯度或浓度梯度。借助膜转运蛋白,多种极性小分子和无机离子,包括水分子、糖、氨基酸、核苷酸以及细胞代谢物等,都可以顺着电化学梯度或浓度梯度完成跨膜转运。
1.葡糖转运蛋白
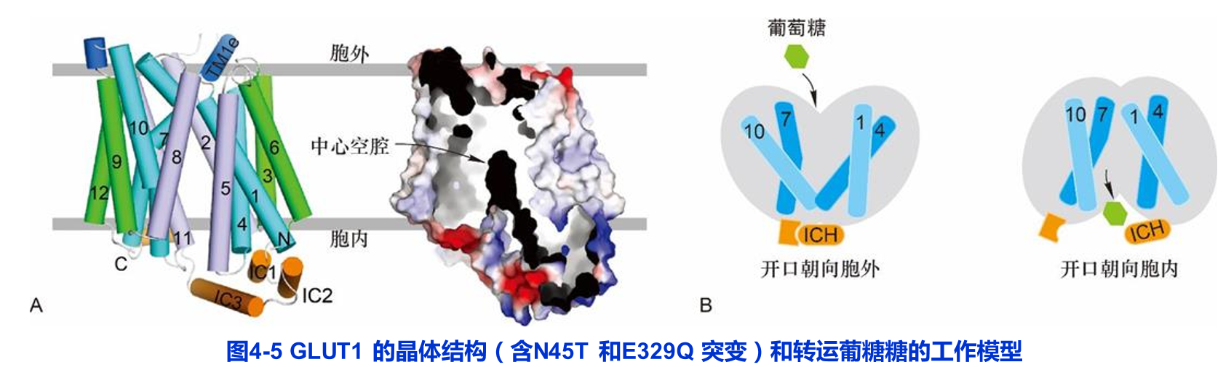
绝大多数哺乳动物细胞都是利用葡萄糖作为细胞的主要能源。人类基因组编码十多种葡糖转运蛋白(glucose transporter,GLUT),构成GLUT蛋白家族,它们具有高度相似的氨基酸序列,都含有12个跨膜的α螺旋。其中, Glut1是介导葡糖糖进入红细胞及通过血脑屏障的主要转运蛋白,对于维持血糖浓度的稳定和大脑供能起关键作用。Glut1三维晶体结构呈现出该家族成员典型的折叠方式——12个跨膜螺旋组成N端和C端两个结构域(图4-5A)。 Glut1通过开口朝向胞外和开口朝向胞内的有序的构象改变过程,完成葡萄糖的协助转运(图4-5B)。
2.水孔蛋白:水分子的跨膜通道
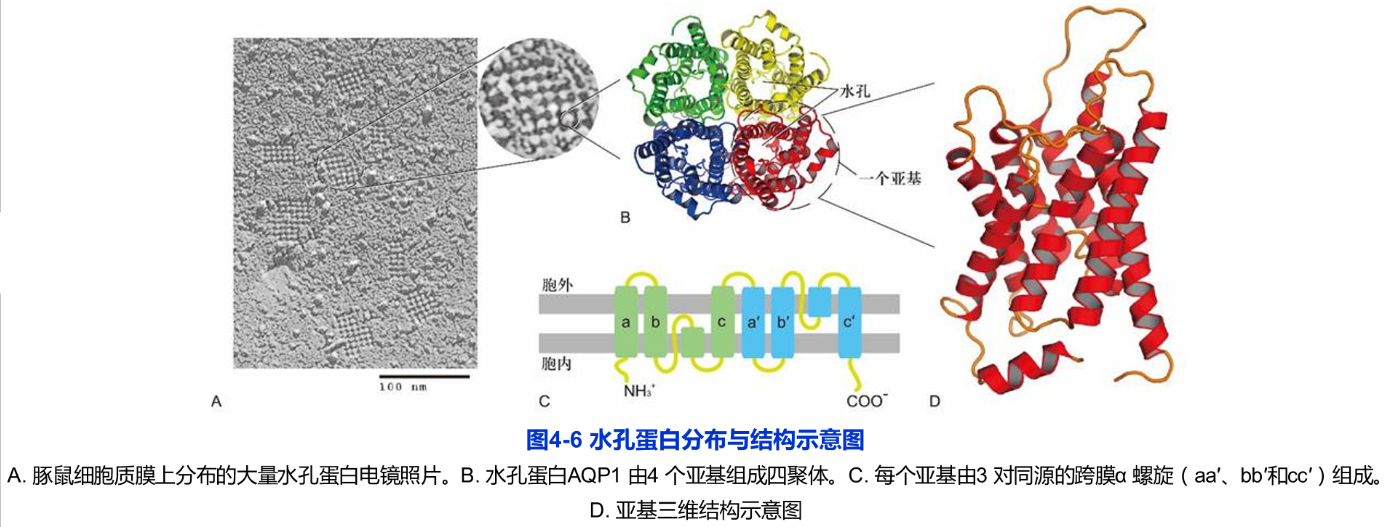
生物体的主要组成成分是水,约占人体质量的70%。水分子不带电荷但具有极性,尽管它可以通过简单扩散的方式缓慢穿过脂双层,但对于某些组织来说,如肾小管和集合管对水的重吸收、从脑中排出额外的水、唾液和眼泪的形成等,水分子就必须借助质膜上的大量水孔蛋白以实现快速跨膜转运(图4-6A)。水孔蛋白对于细胞渗透压以及生理与病理的调节作用十分重要,比如人肾近曲小管对原尿中水重吸收作用,通常个正常成年人每天要产生180L的原尿,这些原尿经近曲小管的水孔蛋白的吸收,大部分水分被人体循环利用,最终只有约1L的尿液排出人体。
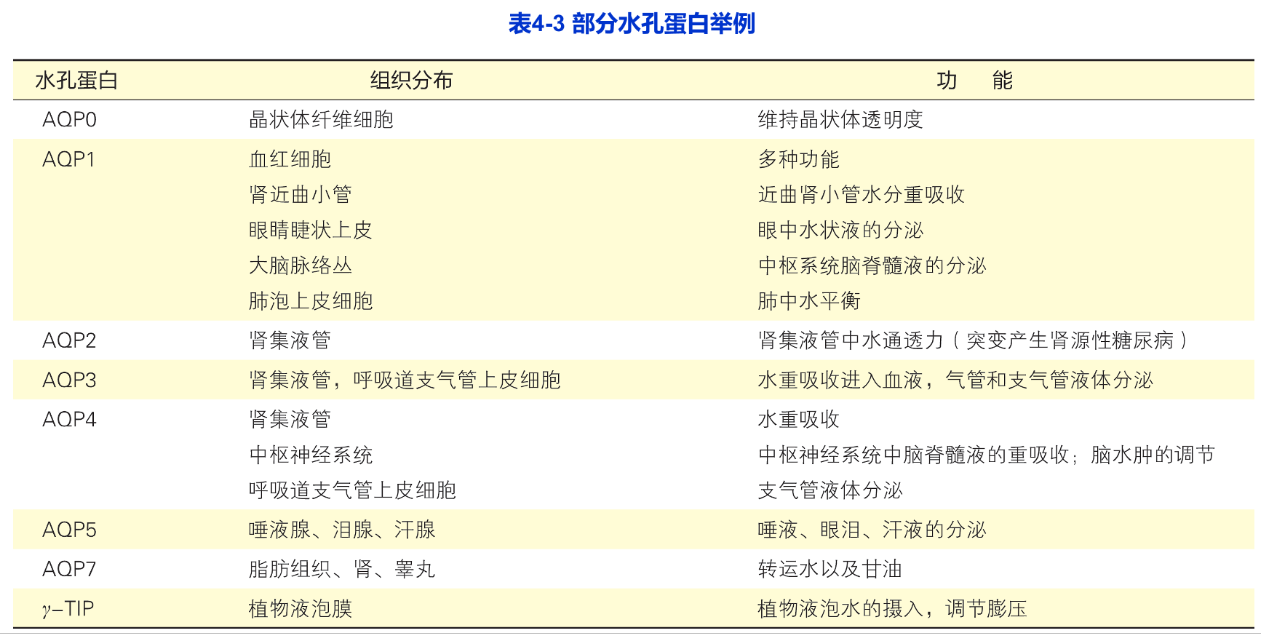
红细胞是研究水孔蛋白的一个理想模型。20世纪80年代,在红细胞膜中发现了第一个水孔蛋白CHIP28(channel-forming integral protein,28kDa),后来统一命名为AOP1。到现在,超过200种水孔蛋白陆续被发现,从细菌到植物、从动物到人,水孔蛋白广泛存在于所有细胞质膜上。水孔蛋白是一个大家族,仅哺乳类细胞至少就发现了十多种水孔蛋白。表4-3列出了部分水孔蛋白的主要分布及其功能。
对AQP1晶体学数据分析表明,水孔蛋白由4个亚基组成四聚体(图4-6B),每个亚基都由6个跨膜α螺旋组成(图4-6C、D)。每个水孔蛋白亚基单独形成个供水分子通过的中央孔,孔的直径稍大于水分子直径,约0.28nm,水孔长约2nm。尽管还没有完全揭示为何AQP1在对水分子快速通过的同时能有效阻止质子的通过,表现出对水分子的特异通透性,但已有的数据表明,这种特异性与两个半跨膜区的Asn-Pro-Ala模式有关。AQP1中央孔的孔径无法通过比水分子大的物质,而两个Asn-Pro-Ala中的Asn残基所带的正电荷也排除了质子的通过,因此,AQP1是一个高度特异的亲水通道,只允许水而不允许离子或其他小分子溶质通过。值得一提的是,有些水孔蛋白对溶质的通透不仅局限于水分子,如AQP8对尿素也有通透性,AQP7对甘油具有通透性。
植物水孔蛋白在种子萌发、细胞伸长、气孔运动以及受精等过程中调节水分的快速跨膜转运。此外,有些水孔蛋白还在植物逆境应答如抗旱性中起着重要作用。
(三)主动运输
与被动运输不同,主动运输是由载体蛋白所介导的物质逆着电化学梯度或浓度梯度进行跨膜转运的方式。主动运输普遍存在于动、植物细胞和微生物细胞。根据能量来源的不同,可将主动运输分为:由ATP直接提供能量(ATP驱动泵)、间接提供能量(协同转运或偶联转运蛋白)以及光驱动泵三种基本类型(图4-7)。
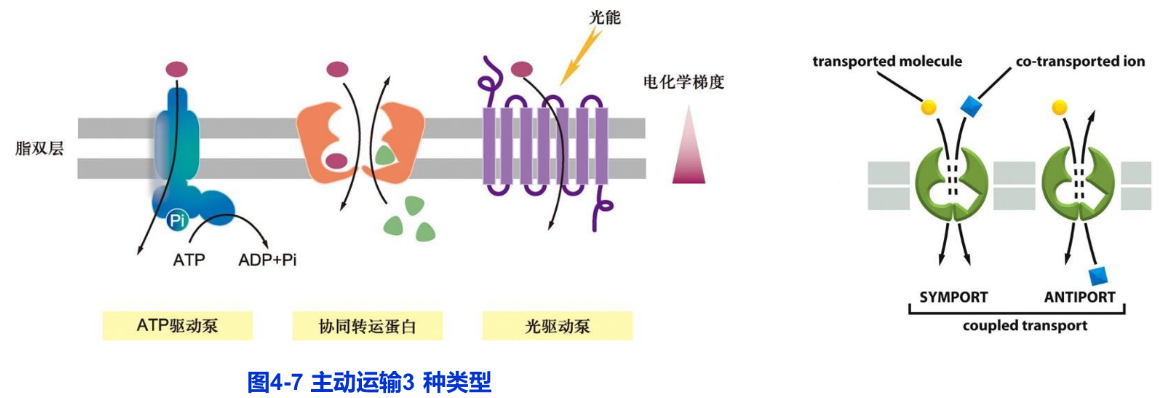
1.ATP驱动泵
ATP驱动泵(ATP-driven pump)是ATP酶直接利用水解ATP提供的能量,实现离子或小分子逆浓度梯度或电化学梯度的跨膜运输。这种主动运输是一种能量偶联的化学反应过程,即离子或小分子逆电化学梯度的“上山”运动(需要能量)与ATP水解(释放能量)相偶联。主动运输每秒转运的离子数为1~103不等。
2.协同转运蛋白
协同转运蛋白(cotransporter)或偶联转运蛋白(coupled transporter)介导各种离子和分子的跨膜运动。这类转运蛋白包括两种基本类型:同向协同转运蛋白(symporter)和反向协同转运蛋白(antiporter)。同向协同转运是偶联物的运输方向相同,如小肠上皮细胞和肾小管上皮细胞吸收葡萄糖或氨基酸等有机物,就是伴随Na+从细胞外流入细胞内而完成的;而反向协同转运是偶联物的运输方向相反,如质膜上Na+/H+交换载体在完成H输出细胞的同时伴随着Na+输入细胞。这两类转运蛋白使一种离子或分子逆浓度梯度的转运与另种或多种其他溶质顺着电化学梯度或浓度梯度的转运偶联起来。与ATP驱动泵直接利用水解ATP提供能量的方式不同,协同转运蛋白所利用的能量储存在其中种溶质的电化学梯度中。在动物细胞的质膜上,Na+是常用的协同转运离子,它的电化学梯度为另一种物质的主动运输提供了驱动力。由于Na+电化学梯度的形成需要Na+-K+泵水解ATP,因此,协同转运是一种间接消耗能量的主动转运方式。在细菌、酵母、植物和动物细胞的被膜细胞器,绝大多数协同运输是靠H+而不是靠Na+电化学梯度来驱动的。协同转运蛋白每秒转运的底物数102-104不等。
3.光驱动泵
光驱动泵(light-driven pump)主要发现于细菌细胞,对溶质的主动运输与光能的输入相偶联,如菌紫红质。


