第二节 ATP驱动泵与主动运输
在三种能量来源形式的主动运输中,最常见的是ATP驱动泵。ATP驱动泵将ATP水解生成ADP和无机磷酸(Pi),并利用释放的能量将小分子物质或离子进行跨膜转运,因此ATP驱动泵通常又被称为转运ATP酶。正常情况下转运ATP酶并不能单独水解ATP,而是将ATP的水解与物质的跨膜转运紧密偶联在一起。根据泵蛋白的结构和功能特性,ATP驱动泵可分为4类:P型泵、V型质子泵、F型质子泵和ABC超家族。前三种转运离子,后一种主要转运小分子(图4-8)。
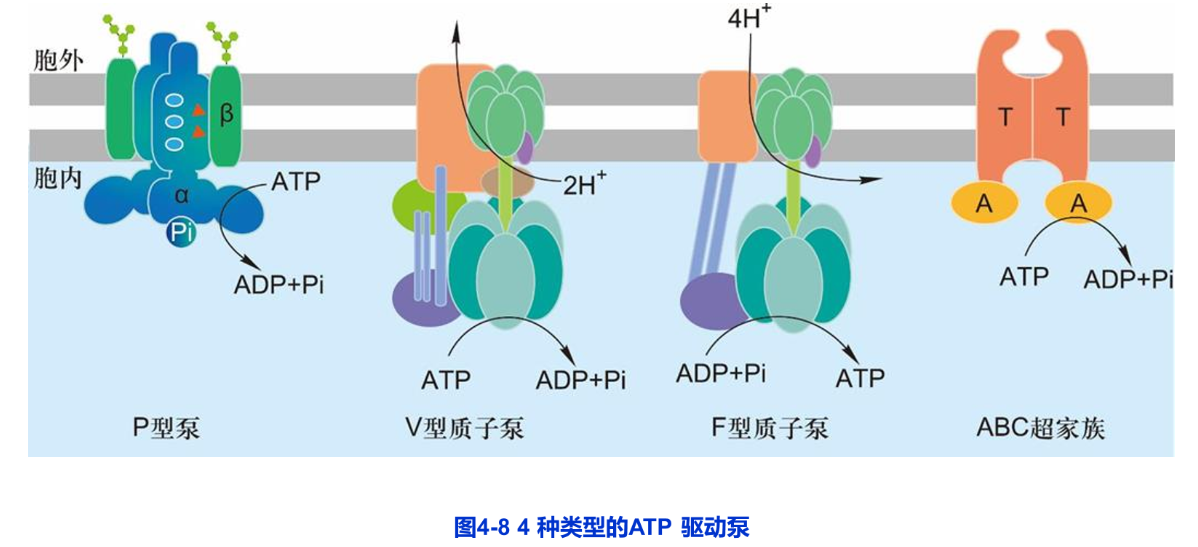
一、P型泵
所有P型泵(P- type pump)都有2个独立的a催化亚基,具有ATP结合位点;绝大多数还具有2个起调节作用的小的β亚基。在转运离子过程中,至少有一个α催化亚基发生磷酸化和去磷酸化反应,从而改变转运泵的构象,实现离子的跨膜转运。由于转运泵水解ATP使自身形成磷酸化的中间体,因此称作P型泵。大多数P型泵都是离子泵,负责Na、K、H和Ca2跨膜梯度的形成和维持。
(一)Na+-K+泵
1.Na+-K+泵结构与转运机制
Na+-K+泵(Na+-K+ pump),又称Na+-K+ ATP酶,位于动物细胞的质膜上,由2个α和2个β亚基组成四聚体(图4-9A),β亚基是糖基化的多肽,并不直接参与离子跨膜转运,但帮助在内质网新合成的α亚基进折叠。Na+-K+泵的转运机制总结在图4-9B中:在细胞内侧α亚基Na+相结合促进ATP水解,α亚基上的一个天冬氨酸残基磷酸化引起α亚基构象发生变化,将Na+泵出细胞,同时细胞外的K+与a亚基的另一位点结合,使其去磷酸化,α亚基构象再度发生变化将K+泵入细胞,完成整个循环。从整个转运过程可以看出,α亚基的磷酸化发生在Na+结合后,而去磷酸化则发生在K+结合后。Na+依赖性的磷酸化和K+依赖性的去磷酸化引起Na+-K+泵构象发生有序变化,每秒钟可发生1000次左右。此外,每个循环消耗一个ATP分子,可以逆着电化学梯度泵出3个Na+和泵入2个K+。这是由ATP直接提供能量的主动转运,而非协同转运,因为Na+和K+都是逆着电化学梯度进行跨膜转运。极少量的乌本苷(ouabain)便可抑制Na+-K+泵的活性(乌本苷的半数抑制量I50为1 μmol/L),而Mg2+和少量的膜脂有助于Na+-K+泵活性的提高,生物氧化抑制剂如氰化物使ATP供应中断,Na+-K+泵失去能源以致停止工作。
2.Na+-K+泵主要生理功能
如表5-1所示,动物细胞胞外Na+浓度比胞内高,而K+比胞内低。一般的动物细胞要消耗1/3的总ATP供Na+-K+泵工作以维持细胞内高K+低Na+的离子环境(神经细胞可消耗高达2/3的总ATP),其生理意义主要体现在以下几方面:
(1)维持细胞膜电位 细胞质膜两侧均具有一定的电位差,称为膜电位(membrane potential)膜电位是膜两侧的离子浓度不同形成的,细胞在静息状态时膜电位质膜内侧为负,外侧为正。每一个工作循环下来Na-K泵将从细胞泵出3个Na并泵入2个K,结果对膜电位的形成起到了一定作用。
(2)维持动物细胞渗透平衡 动物细胞内含有多种溶质,包括多种阴离子以及阳离子。如果没有Na-K泵的工作将Na泵出细胞,那么水分子将由于渗透压的缘故顺着自身浓度梯度通过水孔蛋白大量进入细胞引起细胞吸水膨胀。显然,NaK泵不断地将Na泵到胞外维持了细胞的渗透平衡。胞外除了高浓度的Na外,还有CI(靠膜电位停留在胞外)参与维持动物细胞渗透压平衡。人的红细胞膜上含有丰富的水孔蛋白,如果利用Na-K泵的抑制剂乌本苷处理,红细胞将因为胞外Na浓度降低而不断吸水膨胀,甚至破裂。
不同类型细胞用不同的机制解决渗透压问题。动物细胞靠Na-K泵工作维持渗透平衡,而植物细胞依靠其坚韧的细胞壁防止膨胀和破裂,能耐受较大的跨膜渗透差异,并具有相应的生理功能,如保持植物茎坚挺,调节气孔的气体交换等;生活在水中的一些原生动物(如草履虫),通过收缩泡收集后排除过量的水。
(3)吸收营养 动物细胞对葡萄糖或氨基酸等有机物吸收的能量由蕴藏在Na电化学梯度中的势能提供。
Na-K泵工作形成的Na电化学梯度驱动葡萄糖协同转运载体以同向协同转运的方式,将葡萄糖等有机物转运进入小肠上皮细胞,然后再经Gut2以协助扩散的方式转运进入血液,完成对葡萄糖的吸收(图4-10)。
动物细胞利用膜两侧的Na电化学梯度以协同转运的方式吸收营养物,而植物细胞、真菌和细菌细胞通常利用质膜上的H-ATP酶形成的H电化学梯度来吸收营养物,如在某些细菌中,乳糖的吸收伴随着H从细胞质膜外进入细胞,每转移一个H,吸收一个乳糖分子。
(二)Ca2+泵及其他P型泵
1. Ca2+泵的结构与功能
Ca2是细胞内重要的信号物质,细胞质基质中游离的Ca2浓度始终维持在一个很低水平。细胞质基质中低Ca2浓度的维持主要得益于质膜或细胞器膜上的钙泵(Ca2pump)将Ca2泵到细胞外或细胞器内。Ca2泵,又称Ca2-ATP酶,是另一类P型泵,分布在所有真核细胞的质膜和某些细胞器如内质网、叶绿体和液泡膜上。在肌肉细胞的肌质网膜上,Ca2泵占肌质网膜蛋白90%以上,对细胞引发刺激一反应偶联具有重要作用。对肌质网膜上Ca2泵三维结构已获得高分辨解析(图4-11)。Ca2泵是一个由1000个氨基酸残基组成
的跨膜蛋白,与Na-K泵的a亚基同源,含有10个跨膜α螺旋,其中3个螺旋形成了跨越脂双层的中央通道。在Ca2泵处于非磷酸化状态时,2个通道螺旋中断形成胞质侧结合2个Ca2的空穴,ATP在胞质侧与其结合位点结合,伴随ATP水解使相邻结构域天冬氨酸残基磷酸化,从而导致跨膜螺旋的明显重排。跨膜螺旋的重排破坏了Ca2结合位点并释放Ca2进入膜的另Ca2泵工作与ATP的水解相偶联,每消耗1分子ATP从细胞质基质泵出2个Ca2。Ca2泵主要将Ca2输出细胞或泵入内质网腔中储存起来,以维持细胞质基质中低浓度的游离Ca2。Ca2泵将Ca2泵入肌质网,对调节肌细胞的收缩运动至关重要。在动物细胞质膜上分布的Ca2泵,其C端是细胞内钙调蛋白(CaM)的结合位点,当胞内Ca浓度升高时,C2与钙调蛋白结合形成激活的Ca2-CaM复合物并与Ca2泵结合,进而调节Ca2泵的活性。内质网型的Ca2泵没有钙调蛋白的结合域。
2. P型H+泵
P型泵中除了Na-K泵和Ca泵外,还有H泵(H+ pump)。植物细胞、真菌(包括酵母)和细菌细胞质膜上虽然没有Na-K泵,但有P型H泵(H-ATP酶)。P型H泵将H泵出细胞,建立和维持跨膜的H电化学梯度(作用类似动物细胞Na的电化学梯度),并用来驱动转运溶质进入细胞。细菌细胞对糖和氨基酸的摄取,主要是由H驱动的同向协同转运完成的。P型H泵的工作也使得细胞周围环境呈酸性。
二、V型质子泵和F型质子泵
V型质子泵(V- ype proton pump)广泛存在于动物细胞的内体膜、溶酶体膜,破骨细胞和某些肾小管细胞的质膜,以及植物、酵母和其他真菌细胞的液泡膜上(V为 vesicle第一个字母)。F型质子泵(F- -type proton pump)存在于细菌质膜、线粒体内膜和叶绿体类囊体膜上(F为 actor的第一个字母)。V型质子泵和F型质子泵彼此相似,但与P型泵无关且结构更为复杂。V型质子泵和F型质子泵都含有几种不同的跨膜和胞质侧亚基。两者与P型泵不同,在功能上都是只转运质子,并且在转运H过程中不形成磷酸化的中间体。
Ⅴ型质子泵利用ATP水解供能从细胞质基质中逆H电化学梯度将H泵入细胞器,以维持细胞质基质pH中性和细胞器内的pH酸性;而存在于线粒体内膜、植物类囊体膜和细菌质膜上的F型质子泵却以相反的方式发挥其生理作用。它通常利用质子动力势合成ATP,即当H顺着电化学梯度通过质子泵时,所释放的能量驱动F型质子泵合成ATP,如线粒体的氧化磷酸化和叶绿体的光合磷酸化作用,因此F型质子泵称作H-ATP合酶(又称为FF1ATP合酶)更为贴切。
三、ABC超家族
(一)ABC转运蛋白的结构与工作模式
ABC超家族( ABC Superfamily)也是一类ATP驱动泵,又叫ABC( ATP-binding cassette)转运蛋白。该超家族含有几百种不同的转运蛋白,广泛分布于从细菌到人类各种生物中,是最大的一类转运蛋白。每种ABC转运蛋白对于底物或底物的基团有特异性。所有ABC转运蛋白都共享一种由4个“核心”结构域组成的结构模式(图4-12):2个跨膜结构域(T),每个结构域由6个跨膜α螺旋组成,形成底物运输的通路并决定底物的特异性;2个胞质侧AP结合域(A),具有ATP酶活性,凸向胞质。有些ABC转运蛋白由一条多肽链组成,而有些ABC转运蛋白则由2条或多条装配成相似结构的多肽链构成。ATP分子结合前,ABC转运蛋白的底物结合位点暴露于胞外一侧(原核细胞)或胞质一侧(真核细胞)。一旦ATP分子与ABC转运蛋白结合,将诱导ABC转运蛋白2个ATP结合域二聚化,引起转运蛋白构象改变,使底物结合部位暴露于质膜的另一侧;而ATP水解以及ADP的解离将导致ATP结合域解离,引起转运蛋白构象恢复原有状态。这样,通过ATP分子的结合与水解,ABC转运蛋白就能完成小分子物质的跨膜转运。
细菌除了通过H-ATP酶形成的H电化学梯度来吸收营养物外,其质膜上含有大量依赖水解ATP提供能量逆浓度梯度从环境中摄取各种营养物的ABC转运蛋白。
(二)ABC转运蛋白与疾病
正常生理条件下,ABC转运蛋白是细菌质膜上糖氨基酸、磷脂和肽的转运蛋白,是哺乳类细胞质膜上磷脂、亲脂性药物、胆固醇和其他小分子的转运蛋白。ABC蛋白在肝、小肠和肾等器官分布丰富,它们能将天然毒物和代谢废物排出体外。
由于有些ABC转运蛋白能够将抗生素或其他抗癌药物泵出细胞而赋予细胞抗药性,近些年来,ABC转运蛋白在医学领域引起了极大关注。事实上,真核细胞最早被鉴定的ABC转运蛋白就是从肿瘤细胞和抗药性培养细胞中发现的。这类ABC转运蛋白称为多药抗性( multid rug-resistance,MDR)转运蛋白,在多种肿瘤细胞中高表达,能利用水解ATP的能量将脂溶性的抗癌药物从细胞内转运到细胞外,从而降低细胞内药物浓度,导致肿瘤细胞抗药性增强而降低患者化疗效果。此外,引起疟疾的疟原虫对药物氯喹( chloroquine)的抗性也与病原体ABC转运蛋白高表达有关。
一些人类遗传病的发生与ABC转运蛋白功能改变有关,如囊性纤维化( cystic fibrosis)。囊性纤维化是白人中最常见的一种常染色体隐性遗传病,又称黏稠物阻塞症,是由于囊性纤维化跨膜转运调节蛋白( cystic fibrosis transmembrane conductance regulator, CFTR)4生突变。CFTR是一种ABC转运蛋白,常位于肺、汗腺和胰腺等上皮细胞的顶面(又称游离面),调节Cl-转运。但由于CFTR突变功能异常时,CI转运发生问题,导致细胞外缺水而使得肺部黏稠分泌物堵塞支气管综上所述,主动运输都需要消耗能量,所需能量可直接来自ATP或来自离子电化学梯度;同样也需要膜上的特异性载体蛋白,这些载体蛋白不仅具有结构上的特异性,还具有结构上的可变性。细胞运用各种不同的方式通过不同的体系在不同的条件下完成小分子物质或离子的跨膜转运。
四、离子跨膜转运与膜电位
不同方式的物质跨膜运动,其结果是产生并维持了膜两侧不同物质特定的浓度分布。对某些带有电荷的物质,特别是对离子来说,就形成了膜两侧的电位差。插入细胞微电极便可测出细胞质膜两侧各种带电物质形成的电位差的总和,即膜电位。细胞在静息状态下的膜电位称静息电位( resting potential),在刺激作用下产生行使通讯功能的快速变化的膜电位称动作电位( active potential)。静息电位是细胞质膜内外相对稳定的电位差,质膜内为负值,质膜外为正值,这种现象又称极化( polarization)。在动物不同类型细胞中,静息电位有很大变化,典型的膜电位在-70~-30mV之间静息电位主要是由质膜上相对稳定的离子跨膜运输或离子流形成的。Na-K泵的工作使细胞内外的Na和K浓度远离平衡态分布,胞内高浓度的K是细胞内有机分子所带负电荷的主要平衡者。处于静息状态的动物细胞,质膜上许多非门控的K渗漏通道通常是开放的,而其他离子(如Na、C或Ca2)通道却很少开放。所以静息膜允许K通过开放的渗漏通道顺电化学梯度流向胞外。随着正电荷转移到胞外而留下胞内的非平衡负电荷,结果是膜外正离子过量和膜内负离子过量,从而产生外正内负的静息电位。动物细胞的静息电位值主要反映了跨膜的K电化学梯度。对植物和真菌细胞,静息电位的维持主要是通过ATP驱动的质子泵将大量H从细胞内转运到细胞外。
动物细胞质膜对K的通透性大于Na+是产生静息电位的主要原因,C甚至细胞中的蛋白质分子(一般净电荷为负值)对静息电位的大小也有一定的影响Na-K泵对维持静息电位的相对恒定起重要的作用。
Na+和K+离子通道都是膜上的电压门控通道,它们的开关变化应答于膜电位的变化,或者说电压门控通道打开的概率由膜电位控制。电压门控通道在神经细胞电信号的转导中具有重要作用,它们也存在于其他细胞,包括肌肉细胞、卵细胞、原生动物,甚至植物细胞。电压门控通道有特殊的带电荷的蛋白质结构域,称为电压感受器( voltage sensor),对膜电位的变化极其敏感,从而控制通道蛋白转换它的“关一开”构象。于是,在含有许多通道蛋白分子的膜片内,可能发现当膜处于某一电位时,平均10%的通道是打开的,而处于另一电位时,90%的通道是打开的。
当细胞接受刺激信号(电信号或化学信号)超过一定阈值时,电压门控Na通道将介导细胞产生动作电位。细胞接受阈值刺激,Na通道打开,引起Na通透性大大增加,瞬间大量Na流入细胞内,致使静息电位减小乃至消失,此即质膜的去极化(depolarization)过程。当细胞内Na'进一步增加达到Na平衡电位,形成瞬间的内正外负的动作电位,称质膜的反极化,动作电位随即达到最大值。只有达到一定的刺激阈,动作电位才会出现,这是一种全或无的正反馈阈值,在Na大量进入细胞时,K通透性也逐渐增加,随着动作电位出现,Na通道从失活到关闭,电压门控K通道完全打开,K流出细胞从而使质膜再度极化,以至于超过原来的静息电位,此时称超极化( super polarization)。超极化时膜电位使K通道关闭,膜电位又恢复至静息状态(图4-13)。
膜电位与质膜对K和Na不同的通透性有关,而质膜上Na、K通道蛋白及Na-K泵等膜蛋白也随膜电位变化有规律地关闭和开启。细胞质膜膜电位具有重要的生物学意义,在神经、肌肉等可兴奋细胞中,是化学信号或电信号引起的兴奋传递的重要方式。


