第二节 叶绿体与光合作用
叶绿体(chloroplast)是植物细胞中另一种承担能量转换的细胞器。叶绿体内进行的光合作用是自然界最重要的化学反应。地球上的绿色植物通过光合作用将太阳能转化为生物能源的产能高达2200亿吨/年,相当于全球每年能耗的10倍。可见,叶绿体及其光合作用为地球上包括人类在内的大多数生物提供了必需的能源。由于光合作用将空气中的CO2转换为高能有机碳链,绿色植物中的叶绿体同时还承担着回收大气中CO2的重要作用,受到了全世界的广泛关注。在21世纪人类面临的主要挑战中,粮食和环境问题均涉及叶绿体及光合作用。因此,叶绿体与光合作用的研究在理论和生产上具有重要的意义。
一、叶绿体的基本形态及动态特征
在植物细胞中,叶绿体也是一种动态的细胞器。这种动态表现为光调控下的分布和位置变化、基质小管介导的相互连接、伴随分化和去分化的形态变化以及叶绿体分裂导致的数目变化等。
(一)叶绿体的形态、分布及数目
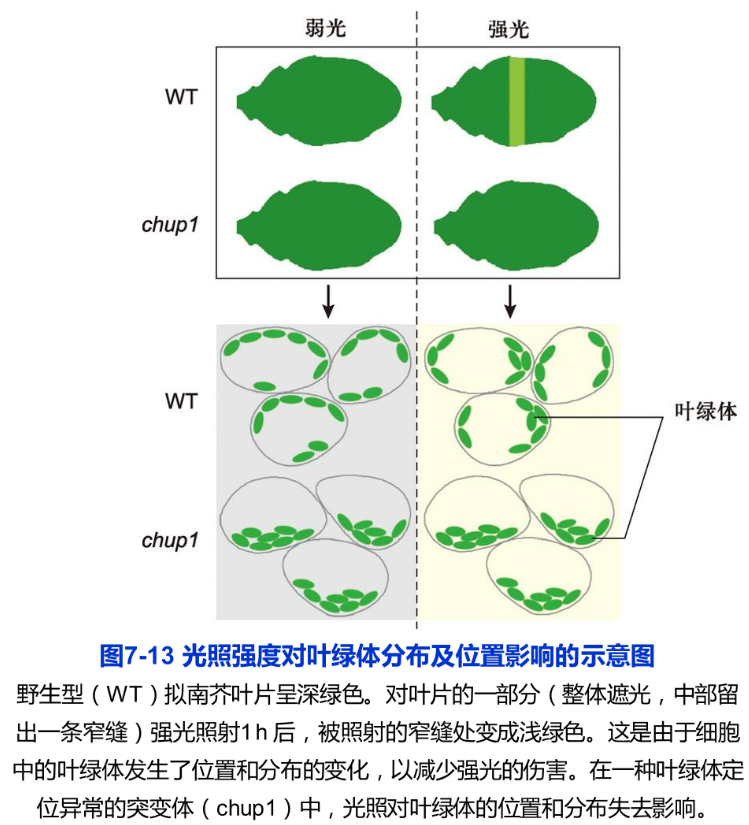
在植物细胞中,叶绿体是最容易观察到的细胞器。这是因为叶绿体中含有叶绿素,与透明的细胞质之间呈现较大的反差。同时,叶绿体体积较大,借助普通光学显微镜的中低倍物镜即可清晰分辨。在高等植物的叶肉细胞中,叶绿体呈凸透镜或铁饼状,直径为5~10m,厚2-41m(图7-12)。由于叶肉细胞内的大部分空间被液泡占据,叶绿体分布在细胞质膜与液泡间薄层的细胞质中,呈平层排列。通常情况下,高等植物的叶肉细胞含20-200个叶绿体高等植物的叶片生长平展后,叶肉细胞内叶绿体的体积和数目相对保持稳定。在环境条件不变的情况下,成熟叶肉细胞中罕见有关叶绿体分裂与融合的报道,这种数目和体积的稳定性有别于线粒体。但细胞内的叶绿体仍呈现动态特征。首先,叶绿体在细胞膜下的分布依光照情况而变化。光照较弱时,叶绿体会汇集到细胞顶面,以最大限度地吸收光能,保证高效率的光合作用;而光照强度很高时,叶绿体移动到细胞侧面,以避免强光的伤害(图7-13)。叶绿体通过位移避开强光的行为称为躲避响应(avoidance response)。相反,在弱光下叶绿体汇集到细胞受光面的行为称作积聚响应(accumulation response)。
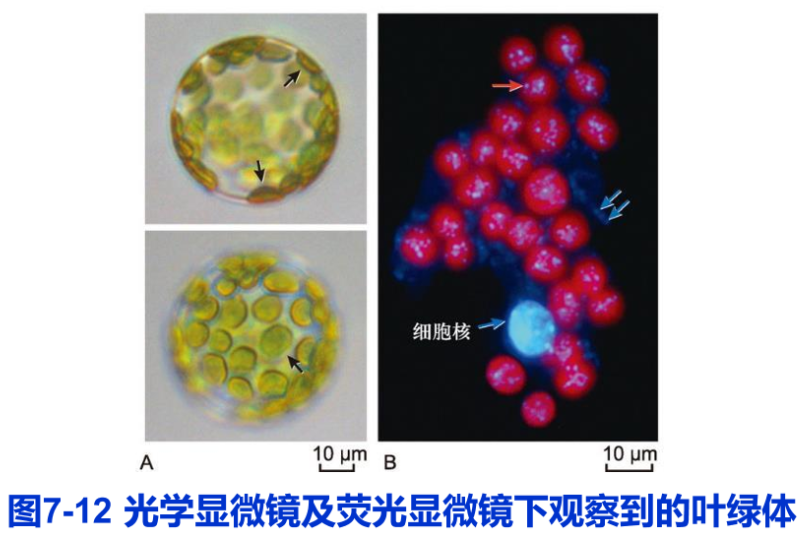
叶绿体在细胞内位置和分布受到的动态调控称为叶绿体定位(chloroplast positioning)。由于光照强度保持稳定状态时叶绿体的分布和位置不呈现明显的变化叶绿体定位至少包括两个必需的细胞动力学环节:叶绿体的移动及移动后在新的最适位置上的“错定”。化学处理破坏细胞内的微丝骨架后,叶绿体定位出现异常,说明叶绿体的运动和位置维持需要借助微丝骨架的作用。在拟南芥的叶肉细胞中,一个被命名为 Chup I(chloroplast unusual positioning I)的微丝结合蛋白为叶绿体正常定位所必需。编码该蛋白质的基因(Chup1)突变后,叶绿体呈现定位异常(图7-13)。研究结果显示, Chup I定位于叶绿体外膜表面,分子质量约112kDa。由于分子上存在肌动蛋白结合域, Chup I很可能是叶绿体与微丝骨架之间实现连接的重要蛋白质,在以微丝骨架为依托的叶绿体定位过程中发挥重要的作用。
与动物相比,植物缺乏主动运动能力。其适应和抵御环境胁迫的机制更多地体现在细胞内独特的生命活动,如叶绿体定位。目前,在介导细胞器运动的马达蛋白中未发现叶绿体特异的马达蛋白。据推测,叶绿体有可能依靠Chup I等蛋白质与微丝骨架形成连接,随着微丝骨架的动态变化而发生位移。
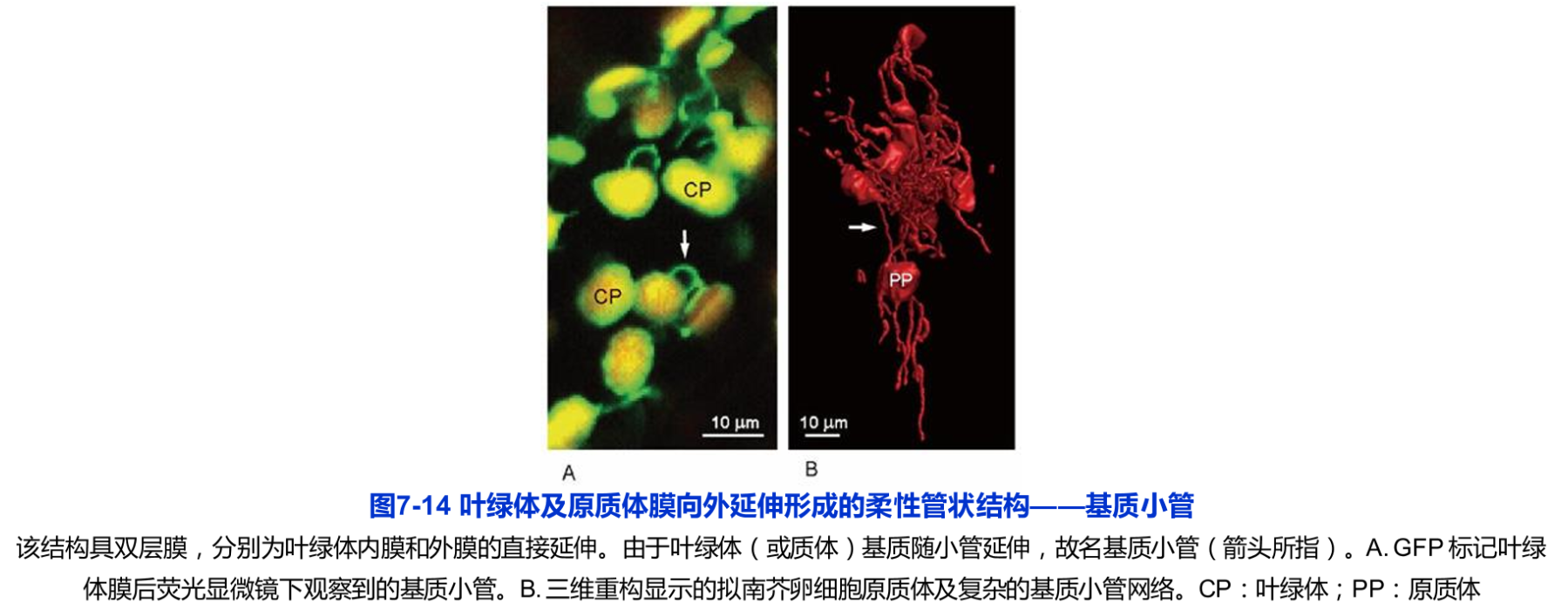
除了位置和分布的变化以外,细胞中叶绿体的动态行为还表现于叶绿体之间的动态连接。与线粒体不同的是,叶肉细胞内罕见叶绿体之间的相互融合。但叶绿体可以通过其内外膜延伸形成的管状凸出(基质小管stroma-filled tubule或 stromule)实现叶绿体之间的相互联系(图7-14)。用GFP标记叶绿体膜后,荧光显微镜下可以观察到基质小管之间频繁的融合与分断。这种动态的融合与分断有助于叶绿体实现实时的物质或信息交换。因此,与线粒体相似,细胞内的叶绿体仍然可以被视作一个不连续的动态整体。实验结果显示,基质小管还可能具备其他重要的细胞学功能,比如将叶绿体代谢中产生的废物输送到液泡中。这些功能的背后尚有许多科学问题值得深入研究。
(二)叶绿体的分化与去分化
叶绿体仅存在于植物茎叶等绿色组织的细胞内。未发芽的种子(胚)细胞中没有叶绿体。在种子萌发过程中,子叶、叶鞘和真叶细胞中的原质体(proplastid)相继分化为叶绿体。这种分化依赖于光照。植物在黑暗条件下生长时,细胞中原质体不能形成叶绿体,幼苗呈黄色。可见,叶绿体是原质体的一种分化方式。在储藏组织(如块根、块茎和胚乳)和一些其他的白化组织中,质体以造粉质体(amyloplast)或白色体(etioplast)的形式存在。
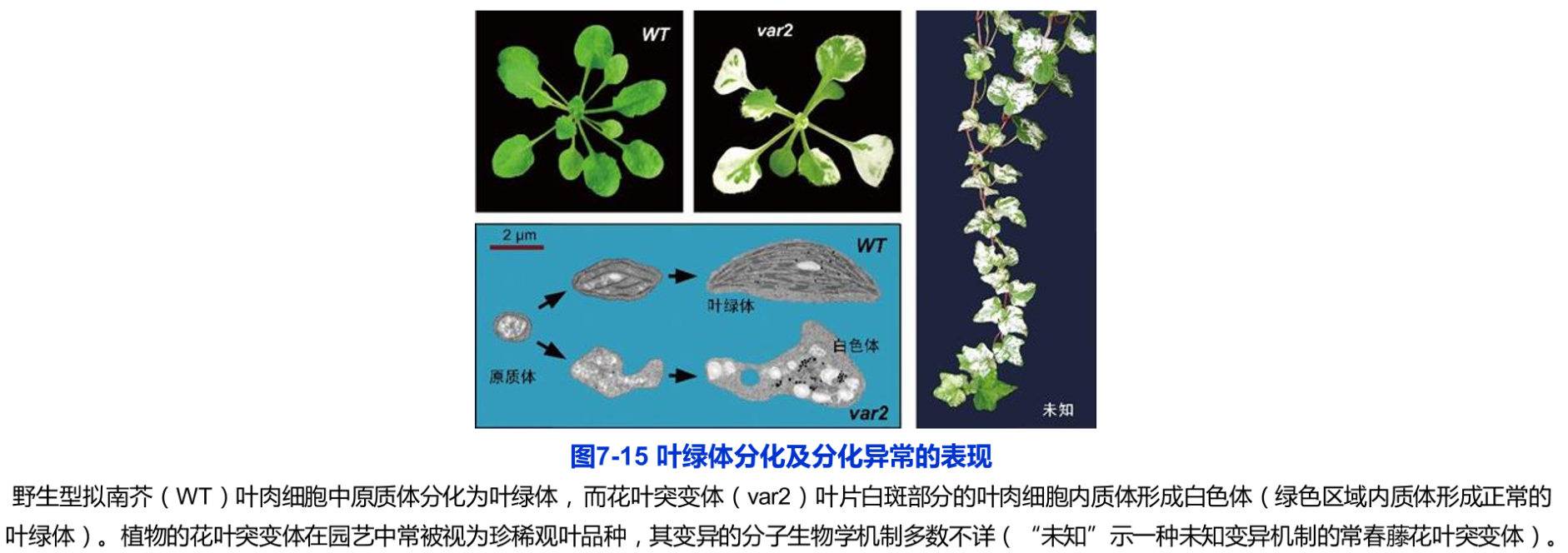
叶绿体分化于幼叶的形成和生长阶段。因此,从生长中的植物顶芽纵切片上,可以观察到分生细胞中的原质体分化形成叶绿体的连续过程。在形态上,叶绿体的分化表现为体积的增大、内膜系统的形成和叶绿素的积累。而在生化和分子生物学上,则体现为叶绿体功能所必需的酶、蛋白质、大分子的合成、运输及定位。据推测,叶绿体的正常工作需要数千个基因的支持。可见叶绿体分化是一个十分复杂的过程。在该过程中,某一个基因的突变或异常往往便会导致叶绿体分化的障碍。植物中常见的白化苗就是叶绿体分化障碍的表现。除了叶绿素合成相关基因的突变直接导致白化外,其他基因的缺陷同样可以导致植物白化,机制多种多样。例如,拟南芥编码叶绿体蛋白酶的基因(Varl及r2)发生突变后,早期质体内多余的蛋白质得不到清除,导致部分叶肉细胞内叶绿体分化异常,叶片出现白斑;园艺中常用的花叶植物(绿色叶片上出现白斑或白色花纹)也是部分叶肉细胞中叶绿体分化出现障碍的结果。白化叶或叶片的白化部分中的质体为白色体(图7-15)。
在特定情况下,叶绿体的分化是可逆的。叶肉细胞经组织培养形成愈伤组织细胞时,叶绿体去分化再次形成原质体。目前,人们对叶绿体分化与去分化的了解还仅限于发现了一些必需的基因。其复杂的调控网络尚不清楚,有待于进一步研究。
(三)叶绿体的分裂
质体和叶绿体通过分裂而实现增殖。在高等植物中,叶绿体的分裂集中发生在生长中的幼叶内。在形态上,幼叶中的叶绿体体积为成熟叶绿体的1/10~1/5,基质内只形成少数基质类囊体,尚未或正在开始形成基粒类囊体。这种分化中的叶绿体被称为前叶绿体(pechloroplast)(图7-15)。观察茎尖分生组织附近的幼叶细胞时,可以发现频繁的前叶绿体分裂现象。但在停止生长的成熟叶片中很少观察到叶绿体分裂,说明细胞内叶绿体数目的调控主要发生于细胞分化和生长的早期阶段。
叶绿体的分裂与线粒体分裂具有相同的结构动力机制。在分裂中的叶绿体上,可以观察到环绕叶绿体的分裂环(chloroplast division ring),亦由外环和内环组成。外环位于叶绿体外膜表面,暴露于细胞质;而内环位于叶绿体内膜下面,暴露于叶绿体基质(图7-16)。
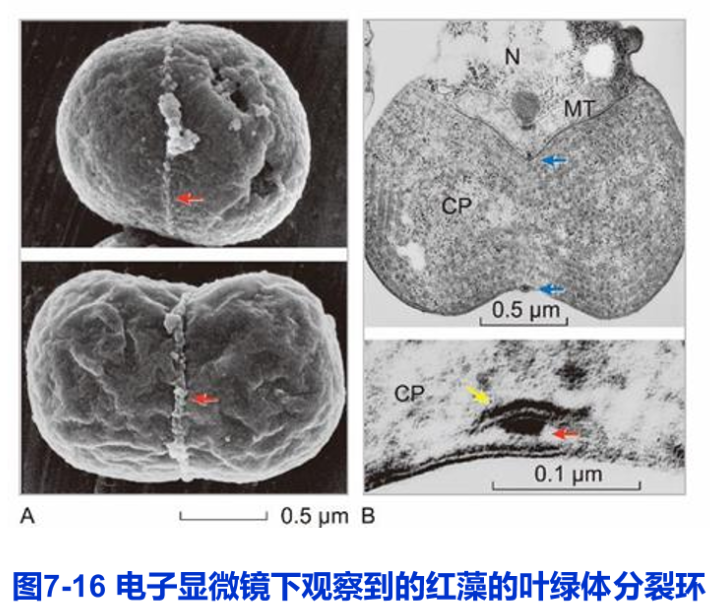
分裂环的缢缩是叶绿体分裂的细胞动力学基础。但需要说明的是,对叶绿体分裂环与线粒体分裂环的认识还仅限于作为电镜下细胞超微结构概念,所涉及的蛋白质分子基础尚不清楚。人们将叶绿体分裂所有相关蛋白质组成的分裂功能单位称为叶绿体分裂装置(chloroplast division apparatus,chloroplast division machinery)。较分裂环而言,分裂装置是一个更为完整的细胞功能概念,包括分裂环和分裂环以外的相关蛋白质。
与线粒体的分裂相似,发动蛋白相关蛋白在叶绿体分裂装置中起着同样的作用。在被子植物中,叶绿体分裂必需的发动蛋白相关蛋白被称为Arc5(accumulation and replication of chloroplasts 5)。该蛋白在叶绿体表面开始缢陷时组装成环状结构,出现于缢陷处,推动叶绿体膜深度缢陷及分断。在分子结构和作用时空上,Arc5与线粒体分裂装置中的发动蛋白类蛋白非常相似,推测可能是分裂外环的重要组成部分。编码Arc5的基因突变导致叶绿体分裂受到抑制,细胞内出现异常大体积的叶绿体。
由于Arc5分子上没有叶绿体膜定位信号,Arc5在叶绿体膜外的外环处的组装需要借助其他蛋白质的作用。研究结果发现,在叶绿体分裂的最早期,FtsZ蛋白先于叶绿体膜的缢陷汇集于叶绿体的内膜下,组装成个环状结构,称为FsZ环或Z环(Ftsz ring,Z ring)。由于Z环的荧光强度在叶绿体膜尚未发生缢陷时最强,而随着叶绿体分裂进程而减弱(图7-17),推测其功能可能是在叶绿体分裂前参与分裂位置的决定,而不是内环的组成蛋白。
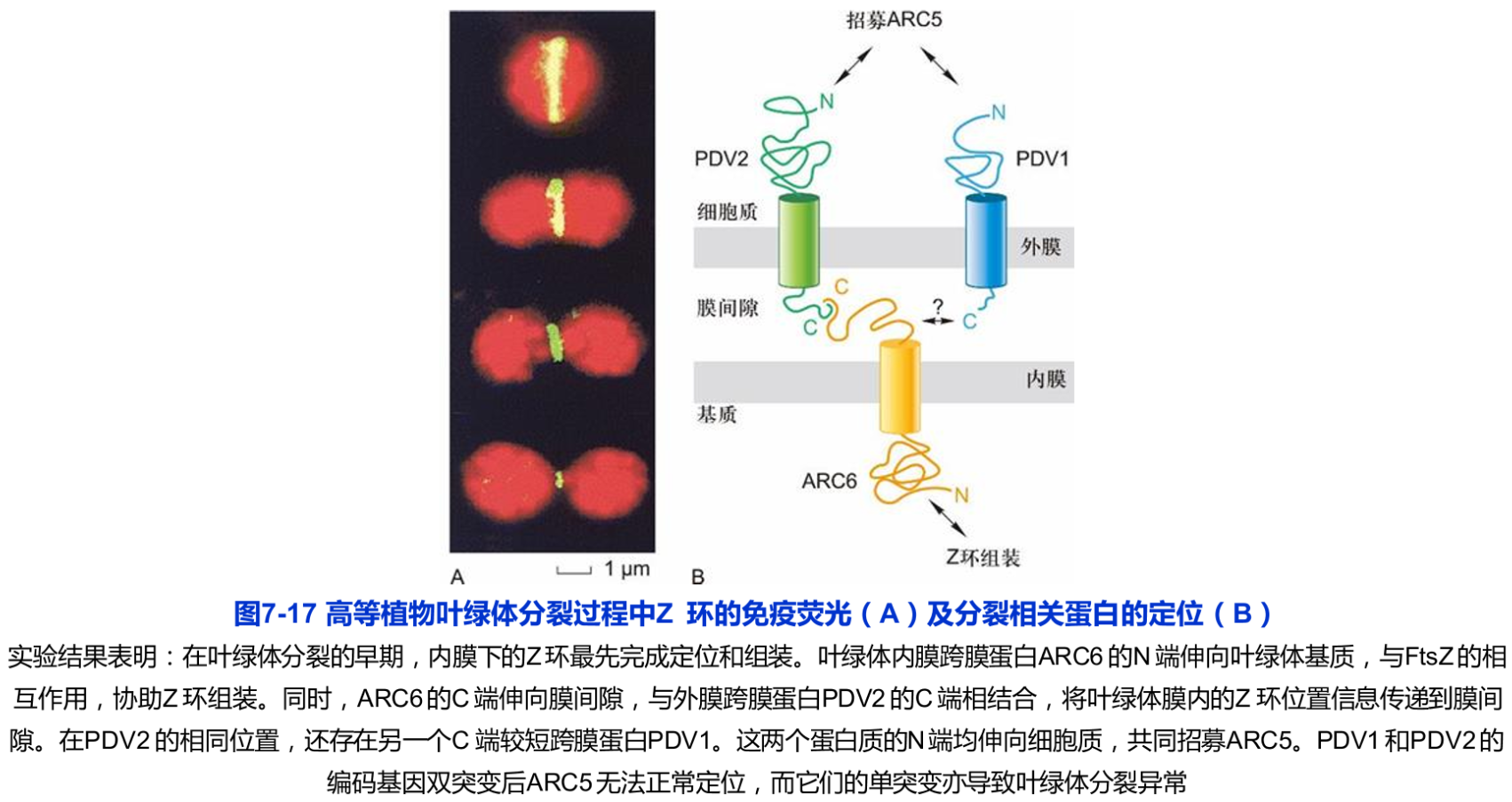
如果叶绿体分裂环和分裂缢陷的位置由最先出现于该位置的Z环决定的话,叶绿体膜内的Z环位置信息必须传递到膜外的相应位置,以招募外环蛋白在该位置汇集和组装。这个推测近期得到了证实。研究结果表明,一个内膜的跨膜蛋白Arc6通过其伸向叶绿体基质的N端实现与FsZ的相互作用,同时其伸向膜间隙的C端与外膜上的跨膜蛋白Pdv2(plastid division 2)的C端相结合。由于Pdv2的N端伸向细胞质并与Arc5相互结合,叶绿体膜内的Z环位置信息通过Arc6传递到膜间隙,再通过Pdv2传递给叶绿体膜外的Arc5(图7-17)。实验结果还显示,编码Ftsz、Ac6、PdVv1和Pav2的基因突变均导致叶绿体分裂障碍,细胞内出现异常大体积的叶绿体。
二、叶绿体的超微结构
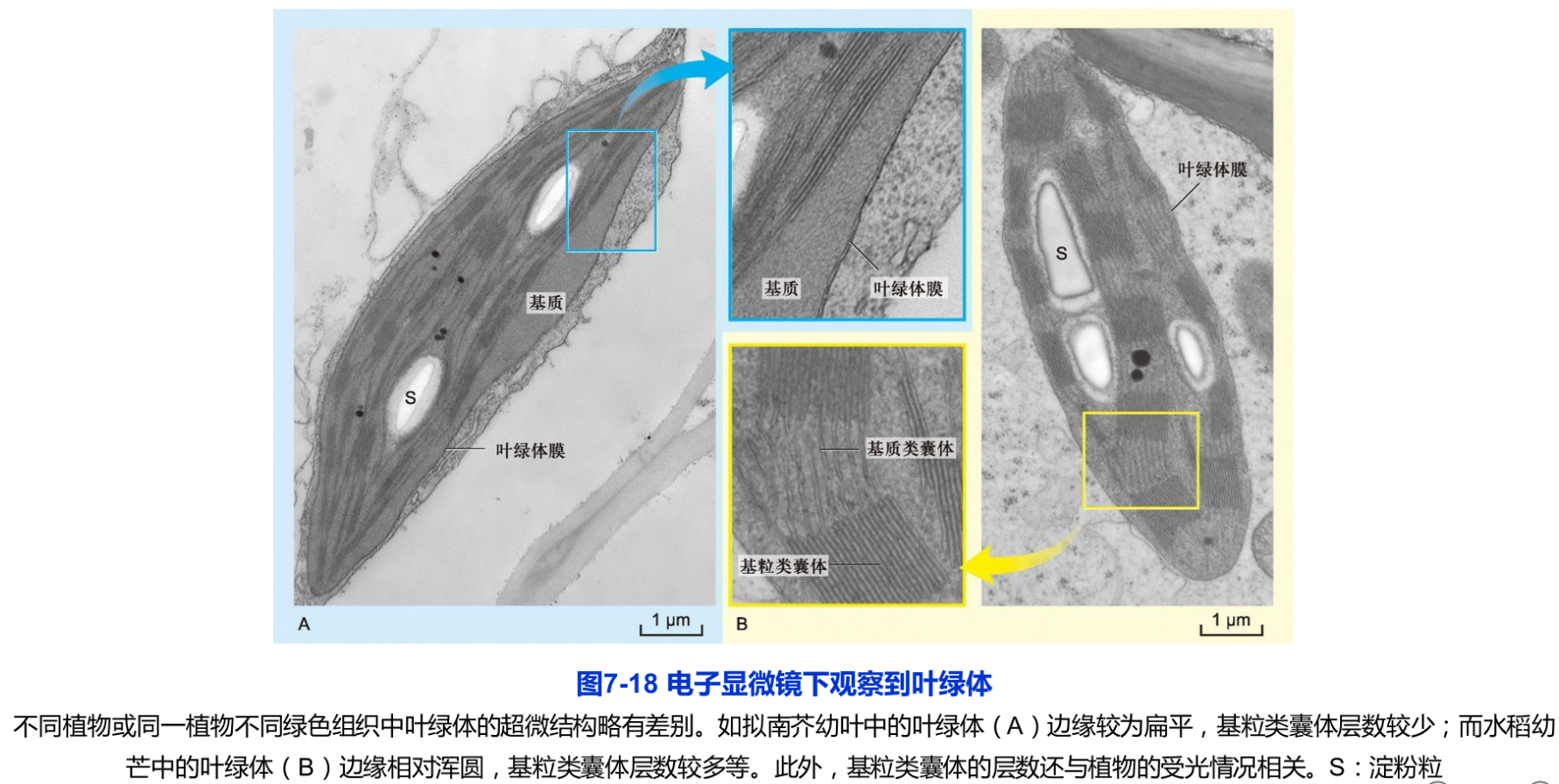
叶绿体的超微结构可以被分为3个部分:叶绿体被膜(chloroplast envelope)或称叶绿体膜(chloroplast membrane)、类囊体(thylakoid)以及叶绿体基质( stroma)(图7-18)。这三部分结构组成一个三维的产能“车间”,为光合作用提供了必需的结构支持。
(一)叶绿体膜
与线粒体相同,叶绿体也是一种由双层单位膜包被的细胞器。其外膜和内膜的厚度为每层6~8nm。叶绿体内、外膜之间的腔隙称为膜间隙(intermembrane space),为10~20nm。与线粒体膜一样,叶绿体的外膜通透性大,含有孔蛋白,允许分子量高达104的分子通过;而内膜则通透性较低,成为细胞质与叶绿体基质间的通透屏障,仅允许O2、CO2和H2O分子自由通过。叶绿体内膜上有很多转运蛋白,选择性转运较大分子进出叶绿体,如磷酸交换载体(phosphate exchange carrier,将细胞质中的无机磷转运到叶绿体基质并将基质中产生的磷酸甘油醛释放到细胞质)和二羧酸交换载体(dicarboxylate exchange carrier,交换含有2个羧基的酸,如苹果酸和延胡索酸)。
(二)类囊体
叶绿体内部由内膜衍生而来的封闭的扁平膜囊,称为类囊体。类囊体囊内的空间称为类囊体腔(thylakoid lumen)。在叶绿体中,许多圆饼状的类囊体有序叠置成垛,称为基粒(granum,复数 grana)。组成基粒的类囊体称为基粒类囊体(granum thylakoid)。而贯穿于两个或两个以上基粒之间,不形成垛叠的片层结构称为基质片层(stroma lamella)或基质类囊体(stroma thylakoid)(图7-18)。基粒类囊体的直径为0.25~0.8μm,厚约0.01μm。一个叶绿体通常含有40~60个甚至更多的基粒。每个基粒由5~30层基粒类囊体组成。基粒类囊体的层数在不同植物或同一植物的不同绿色组织间可出现较大变化。在光照等因素的调节下,基粒类囊体与基质类囊体之间可发生动态的相互转换类囊体垛叠成基粒是高等植物叶绿体特有的结构特征。这种垛叠大大增加了类囊体片层的总面积,有益于更多地捕获光能,提高光反应效率。由于管状或扁平状的基质类囊体将相邻基粒相互连接,叶绿体内的全部类囊体之间实际上是一个完整连续的封闭膜囊。该膜囊系统独立于基质,在电化学梯度的建立和ATP的合成中起重要作用。
类囊体膜的化学组成与其他的细胞膜有明显差异,富含具有半乳糖的糖脂和极少的磷脂。糖脂中的脂肪酸主要是不饱和的亚麻酸,约占87%。这样,类囊体膜的质双分子层流动性非常大,有益于光合作用过程中类囊体膜上的光系统Ⅱ(PS Ⅱ)、 Cyt b6f复合物、光系统I(PS Ⅰ)及CF0-CF1 ATP合酶复合物在膜上的侧向移动。此外,类囊体膜上的蛋白质/脂质的比值很高,同样与叶绿体的光合作用功能相关。
(三)叶绿体基质
叶绿体内膜与类囊体之间的液态胶体物质,称为叶绿体基质。基质的主要成分是可溶性蛋白和其他代谢活跃物质,其中丰度最高的蛋白质为1,5-二磷酸核酮糖羧化酶/加氧酶(ribulose-1,5-biphosphate carboxylase oxygenase,简称 Rubisco)。该酶分子质量为550kDa,由8个大亚基(每个约53kDa)和8个小亚基(每个约14kDa)组成,约占类囊体可溶性蛋白的80%和叶片可溶性蛋白的50%。 Rubisco是光合作用中的一个重要的酶系统,亦是自然界含量最丰富的蛋白质。研究证实, Rubisco的大亚基由叶绿体基因编码,而小亚基由核基因编码。此外,叶绿体基质中还含有参与CO2固定反应的所有酶类,是光合作用固定CO2的场所。除蛋白质外,基质中还含有叶绿体DNA、核糖体、脂滴(lipid droplet)、植物铁蛋白(phytoferritin)和淀粉粒(starch grain)等物质。
三、光合作用
叶绿体的主要功能是进行光合作用。绿色植物、藻类和蓝细菌通过光合作用将水和二氧化碳转变为有机化合物并放出氧气。光合作用是自然界将光能转换为化学能的主要途径,其本质可视为呼吸作用的逆过程。线粒体中的呼吸作用是将氧还原成水,而叶绿体中的光合作用将水光解放出氧。这两个过程逆向进行,前者释放能量,后吸收能量。
高等植物的光合作用由两步反应协同完成,分别被称为依赖光的反应(light dependent reaction)或称“光反应”(light reaction)和碳同化反应(carbon assimilation reaction)或称固碳反应(carbon fixation reaction)。光反应包括原初反应和电子传递及光合磷酸化两个步骤,指叶绿素等光合色素分子吸收、传递光能并将其转换为电能,进而转换为活跃的化学能,形成ATP和 NADPH,同时产生O2的一系列过程。光反应在类囊体膜上进行。固碳反应指在光反应产物即ATP和NADPH的驱动下,CO2被还原成糖的分子反应过程。该过程将活跃的化学能转换为稳定的化学能,在叶绿体基质中进行。
(一)原初反应
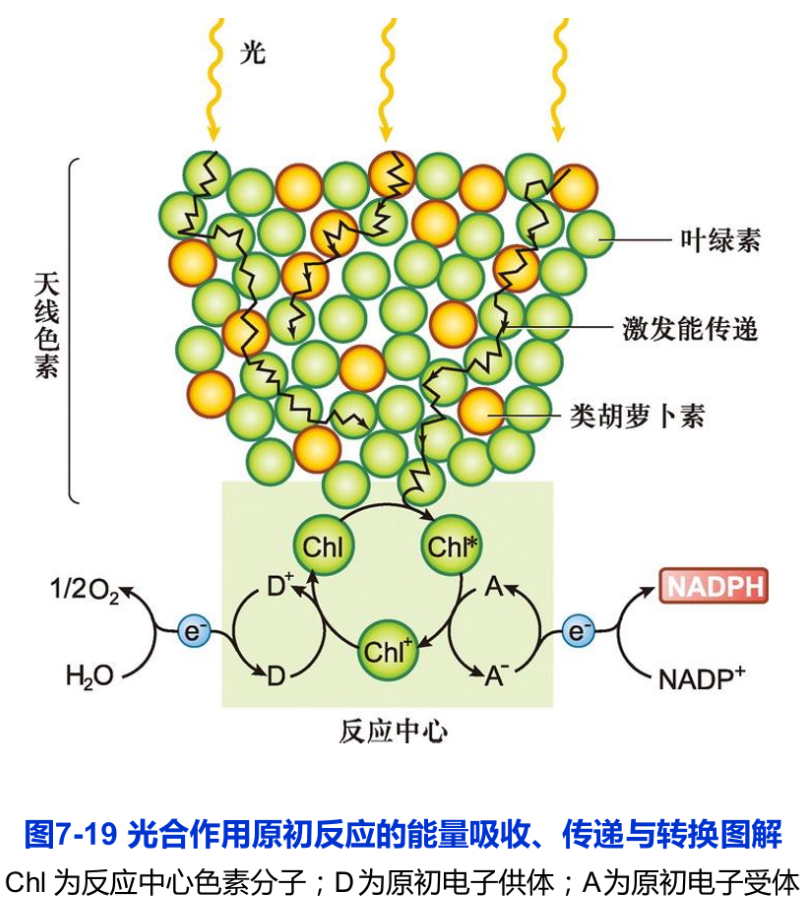
捕获光能是光合作用的初始步骤。原初反应(primary reaction)指光合色素分子被光能激发而引起第一个光化学反应的过程。该过程包括光能的吸收、传递和转换,即光能被天线色素分子吸收并传递至反应中心,继而诱发最初的光化学反应,使光能转换为电能的过程(图7-19)。原初反应只需10-15-10-12s,并可在-196℃低温下进行。
1.光合色素
叶绿体化学成分的显著特点是含有色素(pigment)。色素的特性是分子内含有独特的化学基团,能吸收可见光谱中特定波长的光。植物叶绿体中所含的色素有数十种之多,可分为三类:叶绿素、类胡萝卜素和藻胆素高等植物和多数藻类的叶绿体内含有叶绿素和类胡萝卜素,藻胆素仅存在于一些细菌和藻类中。
叶绿素(chlorophyll)是光合作用的主要色素,在光吸收中起核心作用。高等植物的叶绿体含有叶绿素a和叶绿素b。这两种叶绿素均为绿色,具有不同的吸收光谱,可互补吸收不同范围的可见光。叶绿素分子由卟啉环(porphyrin ring)和叶绿醇(phytol)两部分基团组成。前者具有吸光性和亲水性,后者则具有疏水性。
疏水的叶绿醇插入类囊体膜和脂质结合,起到分子定位作用类胡萝卜素(carotenoid)是类囊体膜上的辅助色素(accessory pigment),呈黄色、红色或者紫色。最重要的类胡萝卜素是β-胡萝卜素(β carotene)和叶黄素(phytoxanthin)。类胡萝卜素能协助叶绿体吸收叶绿素不能吸收的光,提高光吸收效率;同时又能从激发的叶绿素分子上回收多余的能量,以热能的形式释放。叶绿素分子上多余的能量如果不被类胡萝卜素吸收,将转移至氧分子产生单线态氧(O*),引起分子或细胞损伤。因此,类胡萝卜素具有重要的光损伤防护功能。
藻胆素(phycobilin))能够吸收叶绿素不能吸收的杂色光。其吸收的光能可以转移给叶绿素,同叶绿素分子吸收的光能一起进入光反应途径。
实验表明,叶绿体中并非所有的叶绿素分子都直接参与将光能转换为化学能的光化学反应。在大约300个叶绿素分子组成的一个光合单位( photosynthetic unit)中,只有一对特殊的叶绿素a分子,即反应中心色素(reaction center pigment),具有将光能转换为化学能的功能,其余的光合色素称为捕光色素(light harvesting pigment)或天线色素分子(antenna pigment molecule)。后者的作用是吸收光能并将之有效地传递到反应中心色素。
天线色素分子间的能量传递是有序的,即从需能较高的天线色素分子传递到需能较低的色素分子。换言之,能量从吸收短波长光波的天线色素分子传向吸收长波长光波的的天线色素分子。反应中心的叶绿素分子是吸收最长波长光的色素。所有天线色素分子吸收的光能必然且不可逆转地传递给反应中心色素。反应中心色素在直接吸收光能或接受从天线色素分子传递来的光能后被激发,产生电荷分离和能量转换。
2.光化学反应
光化学反应是指反应中心色素分子吸收光能而引发的氧化还原反应。天线色素分子吸收的光能通过共振机制迅速地传递给反应中心色素分子Chl。Chl被激发后形成激发态Chl*,放出电子传给原初电子受体A。这时Chl被氧化为带正电荷的Chl+,而A被还原为带负电荷的A-。氧化态的Chl+再次从原初电子供体D获得电子而恢复为原初状态的Chl,原初电子供体D则被氧化为D+(见图7-18)。这样,氧化还原(即电荷分离)不断发生,电子被不断地传递给原初电子受体A。通过这样的过程,D被氧化而A被还原,光能最终被转换为电能。
(二)电子传递和光合磷酸化
原初反应将光能转换为电能,完成了光反应的第一步。电子随后在电子传递体之间的传递,引起ATP和NADPH的形成,即电能转换为活跃的化学能。这一过程涉及水的裂解、电子传递及NADP+还原。其中H2O是最终电子供体;NADP+是最终电子受体。水裂解释放的电子在沿着光合电子传递链传递的同时,在类囊体膜的两侧建立质子电化学梯度,驱动ATP的合成。
1.电子传递
光合电子传递链(photosynthetic electron transfer chain)由一系列的电子载体构成。这些电子载体包括细胞色素、黄素蛋白、醌和铁氧还蛋白等。它们分别组装在膜蛋白复合物,如PS Ⅰ、PS Ⅱ及 Cyt b6f复合物中(图7-20)。
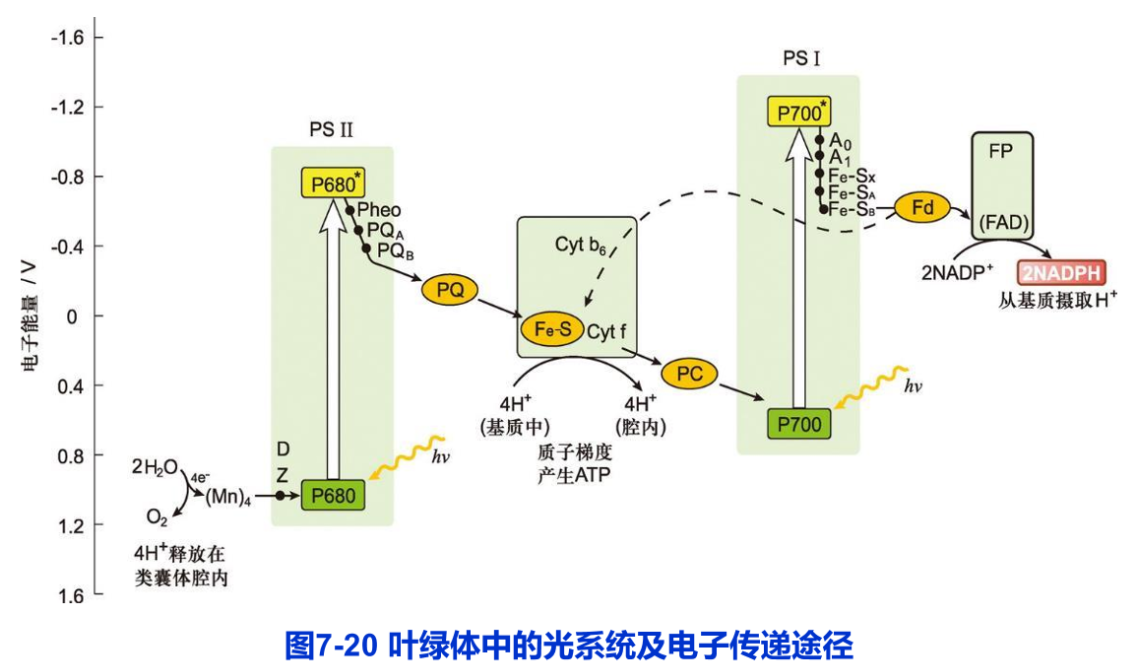
光系统(photosystem,PS)指光合作用中光吸收的功能单位,由叶绿素、类胡萝卜素、脂质和蛋白质组成。每一个光系统复合物含两个组分:捕光复合物(light harvesting complex,LHC)和反应中心复合物(reaction center complex)。在叶绿体的类囊体膜上存在两个不同的光系统:PS Ⅱ和PS Ⅰ。这两个光系统具有独特而互补的功能。它们的反应中心相继催化光驱动的电子从H2O到NADP+的流动(图7-20)。
光系统驱动1个电子从H2O传递到NADP+需要2个光子(每个光系统各吸收1个)。这样,每形成1分子的O2需要4个电子从2个H2O传递到2个NADP+,共需吸收8个光子(每个光系统各吸收4个)。
(1)PS Ⅱ的结构与功能 PS Ⅱ由反应中心复合物和PS Ⅱ捕光复合物(LHC Ⅱ)组成。它们的功能是利用光能在类囊体膜腔面一侧裂解水并在基质侧还原质体醌,使类囊体膜的两侧形成质子梯度。
反应中心复合物是一个由20多个不同多肽组成的叶绿素一蛋白质复合物(图7-21)。这些多肽大多数由叶绿体基因组编码。
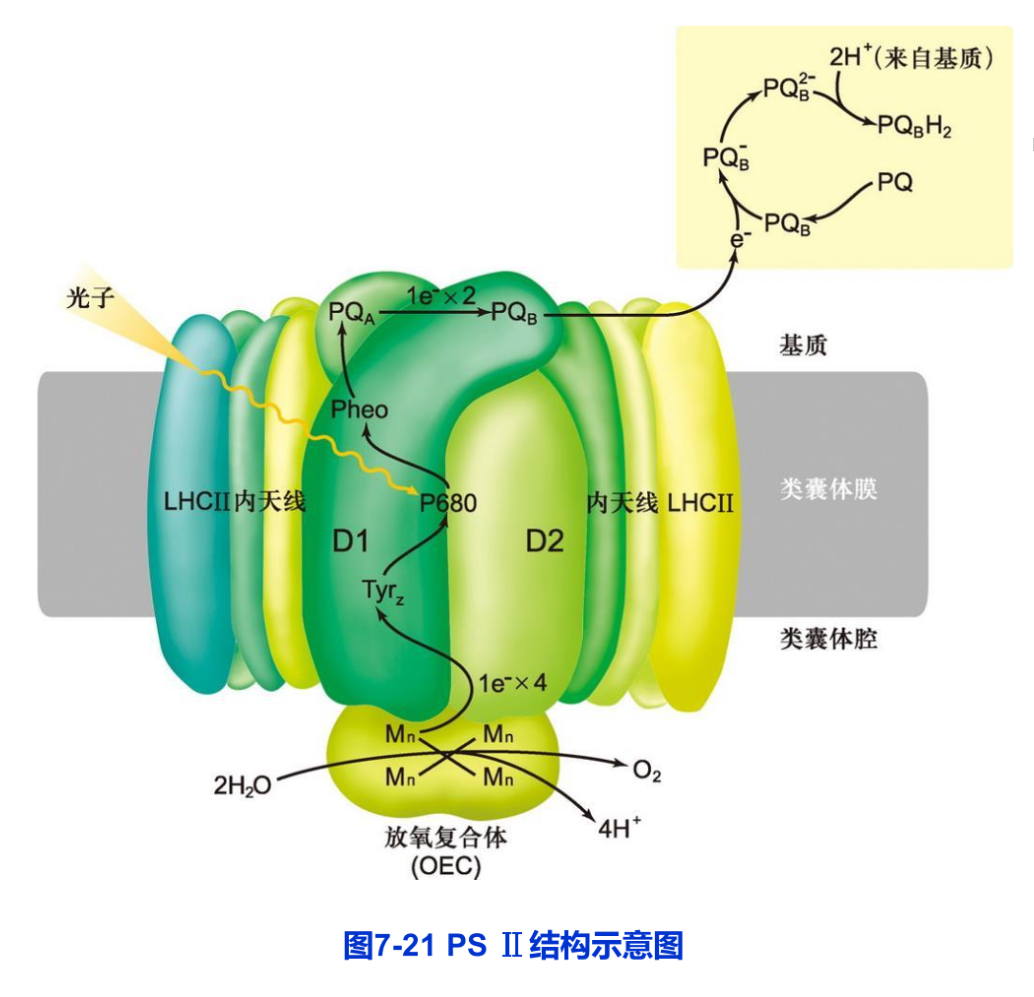
LHC Ⅱ是一个由蛋白质、叶绿素、类胡萝卜素和脂质分子组成的复杂的高疏水性膜蛋白复合物。2004年,中国科学家在《自然》杂志上发表了菠菜LHC Ⅱ的晶体结构,首次提出了LHC Ⅱ的完整结构模型。该结构模型揭示了每一个复合物单体中的14个叶绿素分子(其中8个叶绿素a,6个叶绿素b)和4个类胡萝卜素的排布规律,阐述了LHC Ⅱ高效率进行光吸收和能量传递的分子结构基础。
(2)Cyt b6f复合物的结构与功能 在电子传递过程中,Cyt b6f复合物在PS II和PS I之间承担重要的联系。PS Ⅱ光反应产生的PQBH2脱离D1蛋白后,电子从PQBH2经 Cyt b6f复合物传递至质体蓝素(plastocyanin, PC)并经之传递给PS I中的P700*。 Cyt b6f复合物含有个Cyt b6、一个Fe-S和一个Cyt f(c型细胞色素),和线粒体中的 Cyt bc1的结构与功能相似,都是作为电子载体。 Cyt b6f复合物将电子从双电子载体PQB转运到单电子载体PC,形成一个Q循环。在这个循环中,电子从PQBH2一次一个地传递到PC,引起H+的跨膜转移。在叶绿体中,一对电子的传递导致4个H+从基质转移至类囊体腔。随着电子从PS Ⅱ传递到PS Ⅰ,质子在类囊体膜的两侧形成梯度。
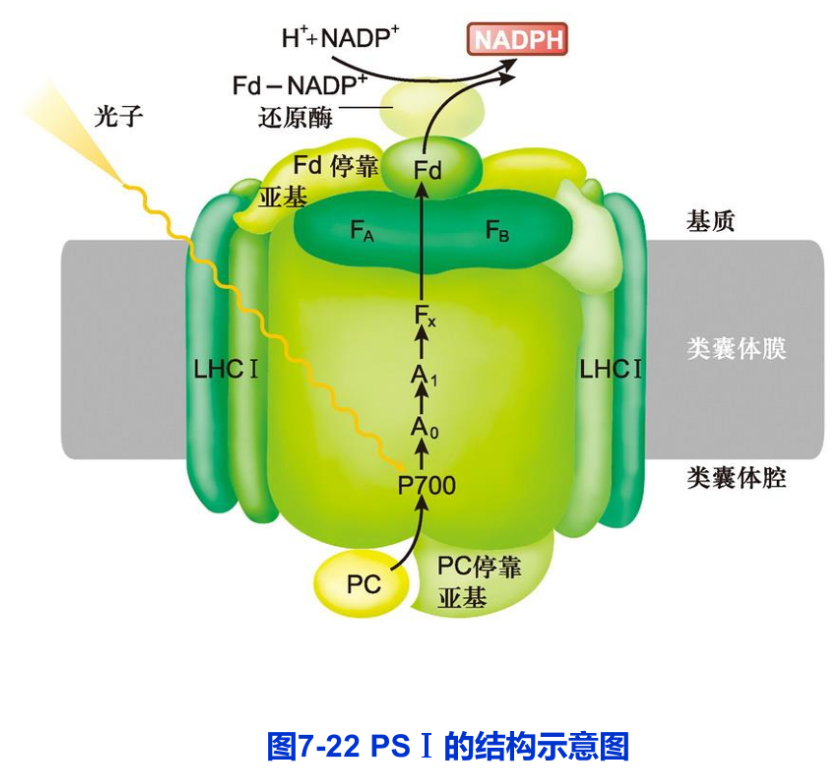
(3)PS I的结构与功能 PS I由反应中心复合物和PS Ⅰ捕光复合物(LHCI)组成(图7-22),其功能是利用吸收的光能或传递来的激发能在类囊体膜的基质侧将NADP+还原为 NADPH。
2.光合磷酸化
由光照所引起的电子传递与磷酸化作用相偶联而生成ATP的过程称为光合磷酸化(photophosphorylation)。光合作用通过光合磷酸化形成ATP,再通过CO2同化将能量储存在有机物中。
(1)CF0-CF1 ATP合酶 在叶绿体中催化ATP合成的酶称为CF0-CF1 ATP合酶(CF0-CF1 ATP synthase),位于类囊体膜外表面朝向细胞质一侧,由CF0和CF1(C代表叶绿体)两部分组成。CF1与线粒体中的F1在亚基组成以及结构和功能上都非常相似,均由α、β、Y、δ、ε 5种亚基组成。CF0是一个跨膜的质子通道,至少有4种亚基组成,与线粒体中的F0同源。
叶绿体ATP合酶的作用机制也与线粒体ATP合酶基本相同。在质子驱动力作用下,ADP和Pi在酶的表面缩合成ATP。同样,ATP从酶分子上释放需要质子驱动力。叶绿体ATP合酶以旋转催化的方式使其中的3个β催化亚基按顺序参与ATP的合成、ATP的释放和ADP与Pi的结合。
(2)光合磷酸化的类型 光合磷酸化依电子传递的方式的不同分为非循环和循环两种类型。
非循环光合磷酸化:由光能驱动的电子从H2O开始,经PS Ⅱ、 Cyt b6f复合物和PS Ⅰ最后传递给NADP+(见图7-19)。非循环光合磷酸化的电子传递经过两个光系统,在电子传递过程中建立质子梯度,驱动ATP的形成。在这个过程中,电子被单方向传递,故称非循环光合磷酸化(noncyclic photophosphorylation)。这种磷酸化途径的产物有ATP和 NADPH(绿色植物)或NADH(光合细菌)。
循环光合磷酸化:由光能驱动的电子从PS Ⅰ开始,经A0、A1、Fe-S和Fd后传给 Cyt b6f,再经PC回到PS Ⅰ(见图7-20)。电子循环流动过程中释放的能量通过Cyt b6f复合物转移质子,建立质子梯度并驱动ATP的形成。这种电子的传递是一个闭合的回路,故称循环光合磷酸化(cyclic photophosphorylation)。循环光合磷酸化由PS Ⅰ单独完成,同时在其过程中只有ATP的产生,不伴随 NADPH的生成和O2的释放。当植物缺乏NADP+时,启动循环光合磷酸化,以调节ATP与NADPH的比例,适应碳同化反应对ATP与 NADPH的比例需求(3:2)。
(3)光合磷酸化的作用机制 光合磷酸化的作用机制与线粒体的氧化磷酸化相似,同样可用化学渗透学说来阐明。在类囊体膜中,光合链的各组分按一定的顺序排列,呈不对称分布。当两个光系统发生原初反应时,类囊体腔中的水分子发生裂解,释放出氧分子、质子和电子,引起电子从水传递到NADP+的电子流(图7-23)。
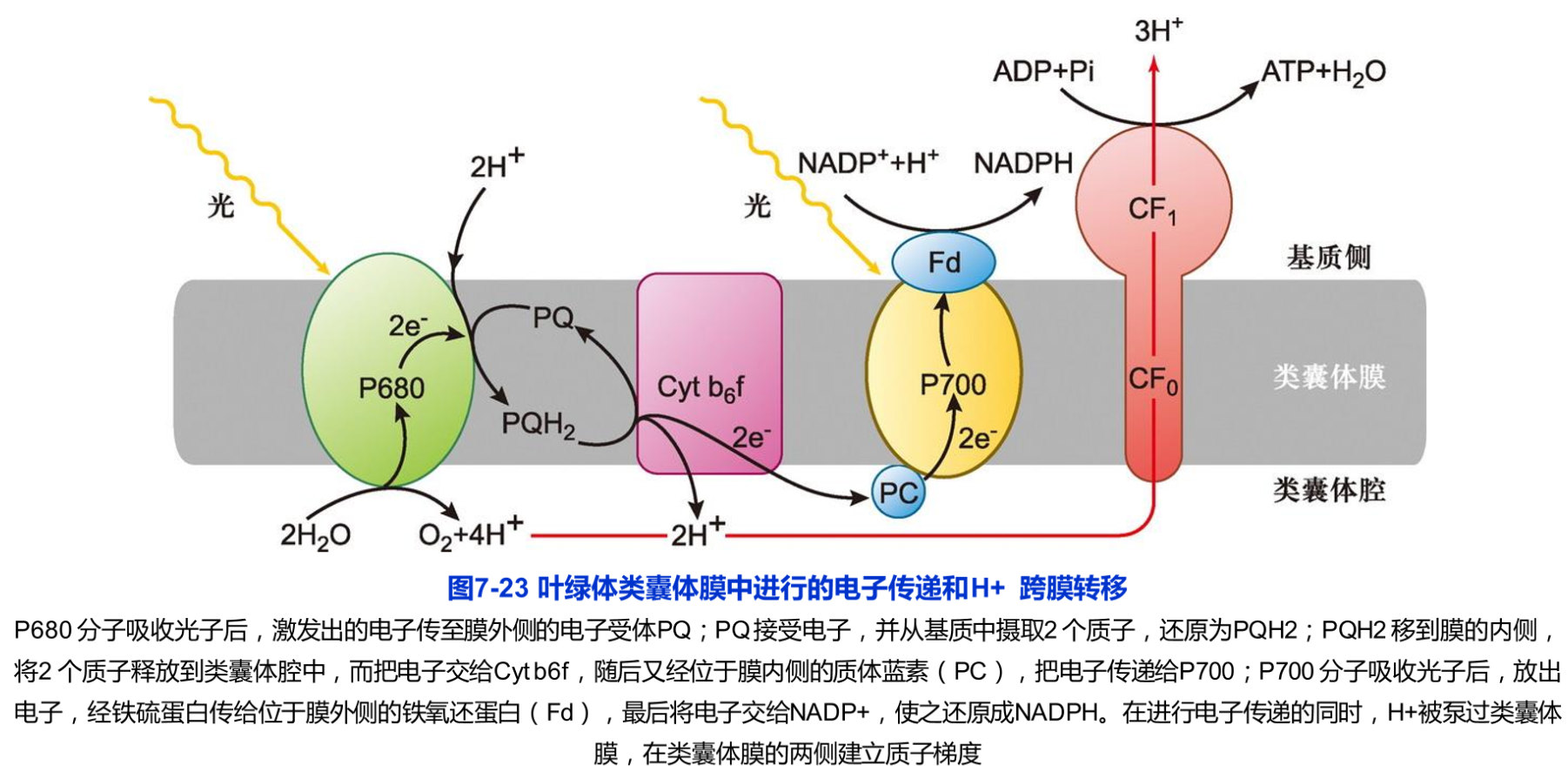
叶绿体中ATP合成的机制也与线粒体的十分相似。通过电子传递,类囊体腔内的H+浓度升高,类囊体膜两侧形成质子梯度。当腔内的H+顺电化学梯度穿越类囊体膜上的ATP合酶(CF0和CF1)时,驱动ADP磷酸化形成ATP。由于CF1位于类囊体膜的基质侧,新合成的ATP被释放入基质。同时,通过PS Ⅰ形成的NADPH也被释放在基质中。这两种光反应高能产物(ATP和 NADPH)随即用于叶绿体基质中的碳同化反应。
(4)ATP合成机制 在光合作用的光反应中,两个光系统的联合作用将水裂解释放出的电子传递到NADP+。在电子从H2O转移到NADP+的过程中,大约每4个电子的转移(即1分子O2的形成)可使类囊体腔中约增加12个H+。其中4个H+由放氧复合体直接提供,另外8个H+由Cyt b6f复合物从基质中摄入。在ATP合成的高峰期,检测结果表明类囊体膜两侧的质子浓度相差约1000倍,相当于3个单位的ΔpH。如此明显的梯度保证了ATP合成的强大驱动力。在电子传递过程中,当H+从基质转移到类囊体腔时,其他阳离子从类囊体腔转移向基质,以保证叶绿体内不会产生明显的膜电位。
(三)光合碳同化
二氧化碳同化(CO2 assimilation)是光合作用过程中的固碳反应。从能量转换角度看,碳同化的本质是将光反应产物ATP和 NADPH中的活跃化学能转换为糖分子中高稳定性化学能的过程。高等植物的碳同化有三条途径:卡尔文循环、C4途径和景天酸代谢(CAM)。其中卡尔文循环是碳同化的基本途径,具备合成糖类等产物的能力。其他两条途径只能起到固定、浓缩和转运CO2的作用,不能单独形成糖类等产物。
1. 卡尔文循环
卡尔文循环(Calvin cycle)以3-磷酸甘油酸(三碳化合物)为固定CO2的最初产物,故也称做C3途径。20世纪50年代卡尔文(M. Calvin)等应用14C示踪的方法揭示了该著名的碳同化过程。由于卡尔文在光合碳同化途径上做出的重大贡献,1961年被授予诺贝尔化学奖。C3途径是所有植物进行光合碳同化所共有的基本途径,包括三个主要的阶段:羧化(CO2固定)、还原和RuBP再生(图7-24)。
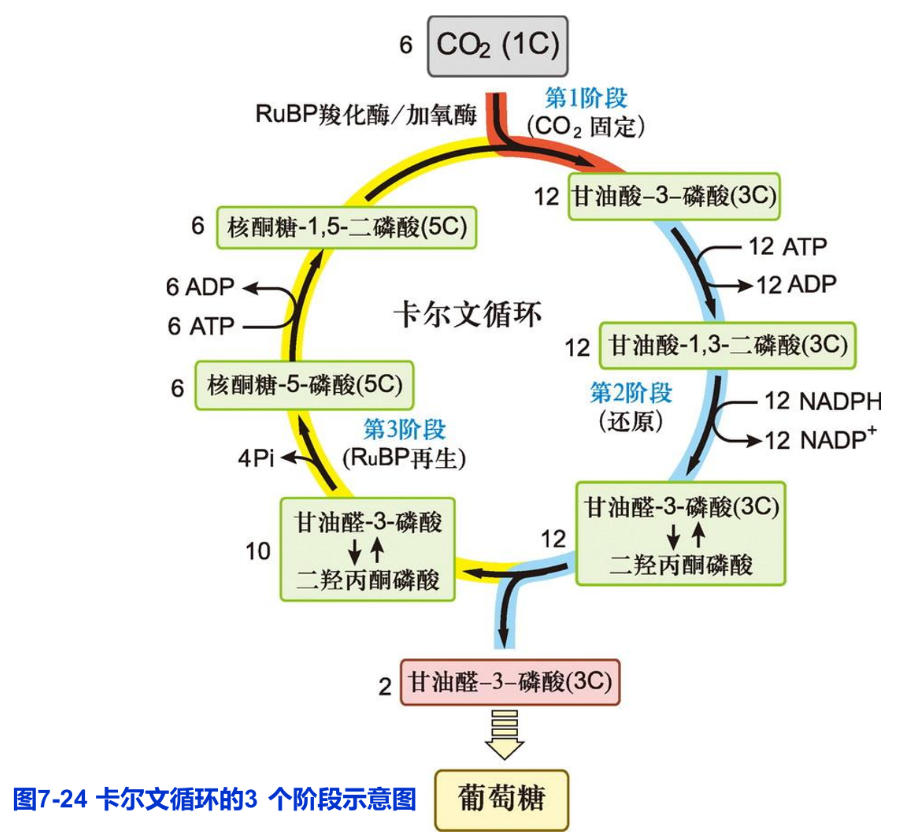
(1)羧化阶段 CO2被 NADPH还原固定的第一步是被羧化生成羧酸。此时,1,5-二磷酸核酮糖(ribulose-1,5- biphosphate,RuBP)作为CO2的受体。在RuBP羧化酶/加氧酶(RuBP carboxylase/oxygenase, Rubisco)的催化下,1分子RuBP与1分子CO2反应形成1分子的不稳定六碳化合物,并立即分解为2分子3-磷酸甘油酸。此过程被称为CO2羧化阶段(CO2 carboxylation phase)。
(2)还原阶段 3-磷酸甘油酸在3-磷酸甘油酸激酶催化下被ATP磷酸化,形成1,3-二磷酸甘油酸,然后在3-磷酸甘油醛脱氢酶催化下被 NADPH还原成储能更多的3-磷酸甘油醛。光反应中生成的ATP和NADPH主要被用于这个过程。因此,还原阶段是光反应与固碳反应的连接点。当CO2被还原成3-磷酸甘油醛时,光合作用的储能过程便告完成。3-磷酸甘油醛等三碳糖可进一步转化,在叶绿体内合成淀粉。
(3)RuBP再生阶段 3-磷酸甘油醛可异构化,形成二羟丙酮磷酸。这两种磷酸丙糖在醛缩酶催化下合成磷酸己糖,然后在一系列酶的作用下,可形成磷酸化的丁糖、戊糖、庚糖。5-磷酸核酮糖在5-磷酸核酮糖激酶的催化下发生磷酸化,消耗1个ATP,再形成RuBP。该反应是第三次耗能反应。RuBP作为卡尔文循环的起始物和CO2的接受体,需要得到不断的再生,以维持循环的连续进行。
综上所述,C3途径以光反应生成的ATP及 NADPH为能源,推动CO2的固定和还原。卡尔文循环每次只固定1个CO2分子,6次循环才能把6个CO2分子同化成1个己糖分子。在能量使用上,循环每固定1个CO2分子需要3分子ATP和2分子 NADPH。
卡尔文循环净反应可表示为:
6CO2+ 18ATP+ 12NADPH → C6H12O6+12NADP++18ADP+18Pi
在糖类化合物中,己糖特别是葡萄糖占据中心位置。葡萄糖是合成纤维素和淀粉的构件分子,被看成是CO2固定的主要终产物。
2. C4途径
20世纪60年代人们发现,除了卡尔文循环以外一些热带或亚热带起源的植物中还存在着另一个独特的CO2固定途径。该途径固定CO2的最初产物为草酰乙酸(四碳化合物),因而被称为C4途径。通过C4途径固定CO2的植物被称为C4植物,如甘蔗、玉米、高梁。C4植物具有一个典型的结构特征,即叶脉周围有一圈含叶绿体的薄壁维管束鞘细胞,其外面整齐环列叶肉细胞与C3植物不同的是,CO2在叶肉细胞中首先与磷酸烯醇式丙酮酸(PEP)反应生成草酰乙酸。这步反应在磷酸烯醇式丙酮酸羧化酶(PEP羧化酶)催化下进行。生成的草酰乙酸具有不稳定性,迅速被还原为苹果酸。叶肉细胞随后将苹果酸转运至维管束鞘细胞。在维管束鞘细胞中,苹果酸被分解再次释放出CO2,进入卡尔文循环。
可见,C4植物的卡尔文循环是在维管束鞘细胞内进行的。叶肉细胞为此提供CO2的供体(苹果酸)。人们普遍认为C4途径是植物适应环境的结果。在热带或亚热带环境中,高温导致强烈的蒸腾作用,植物叶片缺水时调节部分气孔关闭或半关闭,致使叶片中CO2浓度下降,光合作用的效率降低。与C3植物细胞的RuBP羧化酶/加氧酶相比,C4植物叶肉细胞中的PEP羧化酶具有非常高的CO2亲和力,可固定低浓度的CO2。这样,通过高效率固定低浓度CO2并向叶肉细胞输送苹果酸的方式,C4途径保证了维管束鞘细胞中较高的CO2水平(可达大气中浓度的10倍),维持了高热环境下的光合作用。
3. 景天酸代谢
景天酸代谢(crassulacean acid metabolism,CAM)发现于生长在干旱地区的景天科及其他一些肉质植物由于环境干旱,这些植物的气孔白天关闭,夜间开放,以最大限度地减少水分蒸发。由于CO2只能在夜间进入叶片,需要在此间将其固定下来。景天酸代谢与C4途径非常相似,CO2在PEP羧化酶的催化下与磷酸烯醇式丙酮酸结合,生成草酰乙酸,进一步还原为苹果酸。细胞中的苹果酸在白天经氧化脱羧释放CO2,进入卡尔文循环,最后形成淀粉。与C4植物不同的是,景天酸代谢过程中的初级固碳产物(苹果酸)合成和卡尔文循环均在叶肉细胞中进行,不需要细胞间转移。


