4 .抗原提呈的魔力
4.1 抗原提呈的魔力
在免疫系统的所有基础概念中,最精巧、最神奇的概念或许是抗原提呈——一个细胞将蛋白质片段提呈给另一个细胞的概念。正如你所看到的,抗原提呈是获得性免疫系统的中心环节,在将抗原提呈给T细胞群的过程中,抗原提呈细胞(APC)发挥了关键性的作用。首先,我们就位于APC表面具体执行提呈过程的 MHCⅠ类、MHCⅡ类分子作一番讨论。
4.1.1 MHC Ⅰ类分子
MHCⅠ类、MHCⅡ类分子结构现已得到完整的解析,因此对两类分子的形态我们已有一个很好的认识。MHCⅠ类分子具有一个结合沟,该沟两端闭合,因而它们所提呈的蛋白质小片段(多肽)必须与沟相匹配而落在沟内。事实上,当免疫学家从MHCⅠ类分子结合沟中把多肽撬出来并对其进行序列缝隙分析时,他们发现这些多肽分子大小绝大多数为8-11 个氨基酸。这些多肽分子锚定于结合沟的两端,通过多肽分子片段在其中部稍稍向外凸,多肽分子片段在其长度轻微变化后也能被结合沟所容纳。
每个人都有3个MHCⅠ类分子的编码基因,即HLA-A、HLA-B和 HLA-C,定位于6号染色体。由于人类有两条6号染色体,一条来自母亲,一条来自父亲,故我们每个人都有6个MHCⅠ类基因。每一个Ⅰ类HLA 蛋白均与另一个称为β2-微球蛋白的蛋白质配对,形成完整的 MHCⅠ类分子。
在人群中,3个Ⅰ类 HLA 蛋白的编码基因存在轻微的变异形式,例如,HLA-A蛋白的编码基因至少有125个变异体,由这些基因编码的蛋白具有相同的大体形态,但存在一个或几个氨基酸的差异。免疫学家将具有多种形式的分子称为“多态性”。Ⅰ类 HLA分子当然符合这一特征,与此不同的是,我们所有的个体都有相同的β2-微球蛋白,这是“单态性”。
因其多态性,MHCⅠ类分子具有不同的结合基序,因而能提呈具有不同氨基酸末端的多肽。例如,有一些 MHCⅠ类分子能与一端为疏水性氨基酸的多肽结合,而另外一些 MHCⅠ类分子则在该锚定位置更倾向于与碱性氨基酸结合。
由于人类能表达多达6中不同的 MHCⅠ类分子,组合起来,人类 MHCⅠ类分子能提呈多种多样的多肽,而且,虽说MHCⅠ类分子对于多肽末端特定氨基酸的结合十分挑剔,但对蛋白质片段中部氨基酸选择则颇为随意。结果,一个特定MHCⅠ类分子能结合和提呈大量不同的多肽,每一个多肽均与 MHC 结合大沟末端的特定氨基酸相匹配。
4.1.2 MHC Ⅱ类分子
如同MHCⅠ类分子一样,由6号染色体HLA-D区基因编码的MHCⅡ类分子也具有广泛的多态性:在人群中存在许多差异的 MHCⅡ类分子。然而,与MHCⅠ类分子不同的是,MHCⅡ类分子的结合沟两端开放,多肽分子可以伸出沟外。对于该情形,正如你所想象的那样,结合于 MHCⅡ类分子的多肽比占据于MHCⅠ类分子闭合型结合沟内者更大,约为 13-25个氨基酸。另外,对MHCⅡ类分子而言,锚定多肽的氨基酸沿着结合沟间隔分布,而不是簇集于两端。
4.1.3 MHC Ⅰ类分子分子介导的抗原提呈
MHCⅠ类分子是由细胞产生的蛋白质片,是展示于细胞表面的公告牌。免疫学家称其为内源性蛋白质。内源性蛋白质包括正常的细胞蛋白质如酶和结构蛋白,也包括由感染细胞的病毒和其他寄生物所编的蛋白质。例如,当病毒进入细胞后,病毒利用宿主细胞的生物合成机制,以生产病毒基因编码的蛋白质。这些病毒蛋白的一个样本连同所有正常细胞蛋白样本均由 MHCⅠ类分子所展示。因此 MHCⅠ类分子公告牌公示了细胞内正在合成的所有蛋白质的“抽样结果”。尽管不同的细胞表达的 MHCⅠ类分子数量各异,但人体内几乎所有的细胞均在其表面表达有 MHCⅠ类分子。CTL审查由MHCⅠ类分子展示的蛋白质片段,因此,几乎每一个细胞但是一本“打开的书”,均可被CTL检查,以确定该细胞是否被病毒或其他寄生物侵袭,决定是否应该破坏之。内源性蛋白被加工及装载到MHCⅠ类分子上的过程十分有趣。通常,在细胞浆内mRNA被翻译成蛋白质,该过程进行得非常精确。但是,有时发生了某些错误,新铸造的蛋白质不能正确折叠,因此是无用的,另外因正常耗损也可导致蛋白质损伤。因此,为了确保细胞内不被缺损蛋白质所充斥,老的或无用的蛋白质进入胞浆内蛋白质销毁“装置”内,该装置的功能类似于木工“錾刀”。这些蛋白质錾刀被称为蛋白酶体,它们将蛋白质切割成小片段,这些多肽小片段绝大多数随后进一步裂解成单个氨基酸,被重新用于蛋白质合成。但是蛋白酶体裂解产生的一些多肽能被特异性转运蛋白(TAP1、TAP2)所携带,穿过内质网膜。内质网是细胞内一个巨大的囊状结构,在该结构内绝大多数蛋白质将被转运至细胞表面,开始它们的旅行。
一旦进入内质网,某些多肽被选中、填入 MHCⅠ类分子结合沟内。我说“选中”,是因为正如我们所讨论的,并非所有的多肽都能满足相关条件。首先,多肽分子须具有适当长度——约9个氨基酸;其次,多肽末端氨基酸必须与衬于MHC分子结合沟两端的锚定氨基酸相容。显然,并不是所有由蛋白酶体准备的“碎片”都具有这些特征,那些不符合条件的多肽分子被转运出内质网,回到胞浆中进一步降解。一旦MHCⅠ类分子装载了多肽分子片段,它们将移向细胞表面并被展示。因此,MHCⅠ类分子展示的前期准备有3个重要步骤:由蛋白酶体产生多肽;由TAP转运体将多肽转运至内质网;多肽结合于MHCⅠ类分子结合沟内。
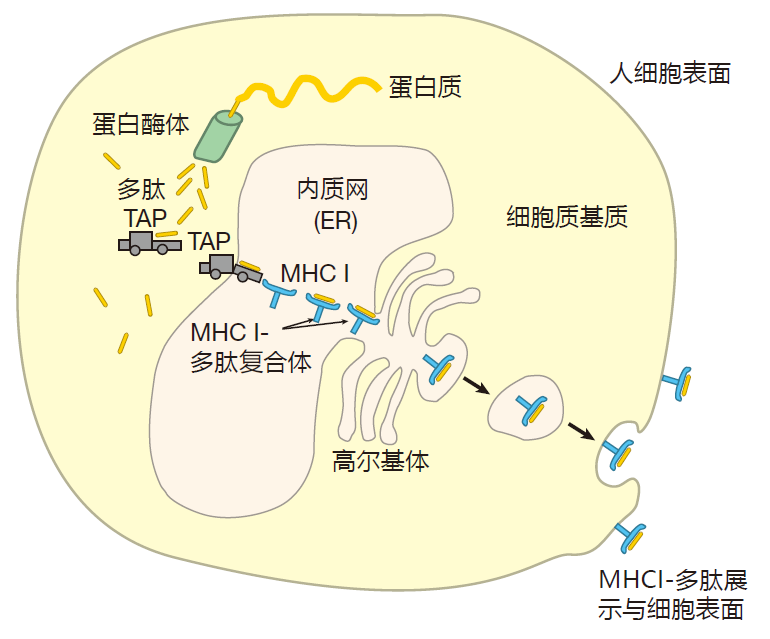
在“普通”细胞如肝脏细胞和心脏细胞中,蛋白酶体的主要功能是处理缺损蛋白质。因此,正如你能想像得到的,这些细胞内“錾刀”对于蛋白质如何被切割不是十分挑剔,只要劈开就行。结果,某些多肽适合于MHC提呈,但绝大多数并不适合。与此不同,在专职APC如巨噬细胞中,切割加工并非如此随意。例如IFN-γMHCⅡ类分子免疫学家把一个给定的BCR所识别的抗原称之为同源抗原,把同源抗原上BCR真正结合的微小区域称之为表与巨噬细胞表面受体分子结合可上调LMP蛋白的表达,而这些LMP蛋白限定蛋白酶体,使之优先在疏水性或碱性氨基酸之后切割蛋白质。你或许会问为什么会这样?这是由于TAP转运体和MHCⅠ类分子均偏爱羧基末端为疏水性氨基酸或碱性氨基酸的多肽。所以,在APC中,LMP蛋白修饰标准蛋白酶体,使之能产生特定的多肽,继而提高MHCⅠ类分子的展示效率。
蛋白酶体对其所制备的多肽分子大小也不是十分严格,但是由于适合于MHCⅠ类分子提呈的多肽分子片段约为9个氨基酸,你可以想像:内质网将会被太长或太短而无用的多肽分子所充斥。但是,事实证明,TAP转运体对介于8-13个氨基酸的多肽具有最高的亲和力。因此,TAP转运体对由蛋白酶体产生的多肽进行筛选,并且优先转运那些C末端具有正确氨基酸残基类型及大体上具有正确分子片段长度可与MHCⅠ类分子相结合的多肽。
这一“切割加工并提呈”系统的严格重要特征是所有新合成的蛋白质至少有30%是结构上存在缺损的(如错误折叠),且必须由蛋白酶体裂解。因而许多蛋白质在其产生后不久就被切割、展示于MHCⅠ类分子上,这就意味着,在其被切割加工、提呈之前,你不必等待蛋白质耗损,这就使得免疫系统对感染产生更迅速的反应成为可能。
4.1.4 MHC Ⅱ类分子分子介导的抗原提呈
MHCⅠ类分子被设定为提呈蛋白质片段至CTL,而 MHCⅡ类分子则提呈多肽分子至Th。而且,MHCⅠ类分子表达于几乎所有的细胞,而 MHCⅡ类分子只表达在免疫细胞上,这一现象很有意义。MHCⅠ类分子擅长于提呈细胞内制造的蛋白质,因而,无所不在的MHCⅠ类分子使得CTL 有机会检查机体内绝大多数细胞,以监视病毒或其他感染,另一方面 MHCⅡ类分子的功能犹如——公示细胞外正在发生的事情的“公告牌”,将危险警示于Th。因此,须执行该任务的表达MHCⅡ类分子的细胞相对较少——仅对机体不同部位的环境提供抽样信息。
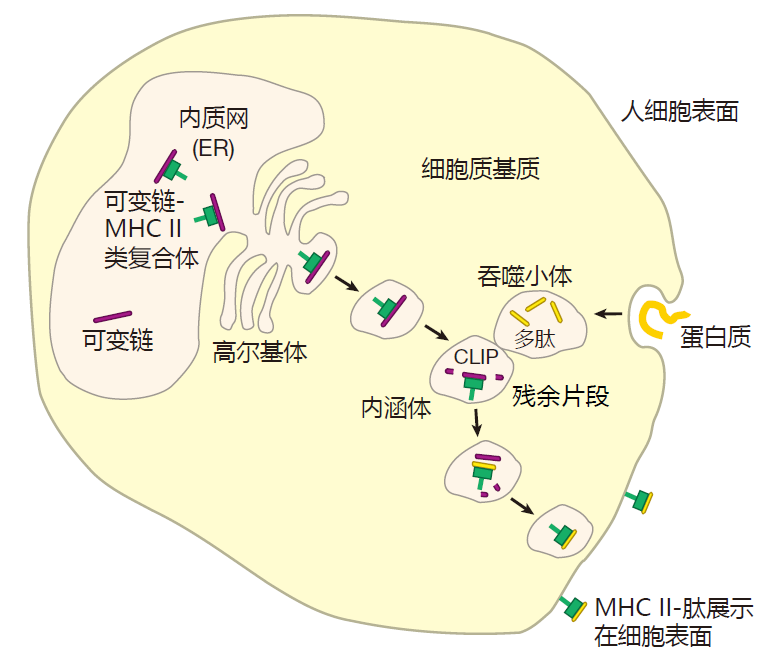
组成 MHCⅡ类分子的两种蛋白质在胞浆中产生并被注入内质网,在那它们于被称为可变链的第三种蛋白质结合。该可变链蛋白执行下列多种功能:首先,可变链蛋白占位于MHCⅡ类分子的结合沟,使其再不能获取内质网中其他多肽。
这一点非常重要,因为内质网中充斥着内源性多肽,它们被蛋白酶体加工后装载于MHCⅠ类分子上。如果这些蛋白质片段被装载于MHCⅡ类分子,那么MHCⅠ类分子和Ⅱ类分子将展示同种多肽:产自细胞内的蛋白质。由于MHCⅡ类分子提呈来自细胞外的抗原,因此,可变链通过扮演“伴侣分子”来执行其重要功能,以确保内源性多肽再内质网中不被 MHCⅡ类分子搭载。
可变链的第二个功能是引导 MHCⅡ类分子穿过高尔基体叠层加工,来到胞浆中叫做内体(endosome)的特殊小泡内。在内体中 MHCⅡ类分子与多肽搭载。然而,我必须提醒你的是,当生物学夹对某一事物还不甚明了时,他们往往把它称作“-some”,这里也不例外,因为对这些内体中发生了什么事情,我们知之甚少。
目前认为,在MHCⅡ类分子从内质网行进到内体的过程中,细胞外游荡的蛋白质被带进细胞内,被包裹入吞噬体中。该吞噬体进而继而与内体融合,内体中的酶作用于吞噬体内的外源性蛋白质,将其切割加工成多肽分子。在该过程中,内体酶同时破坏所有的可变链,只留下那些能真正保护 MHC分子结合沟的分子片段,但是 MHC分子本身却未受损伤,同时,一种被称作DM的细胞蛋白也到达内体,结合于MHC分子上,并将可变链的残余片段(CLIP)释放,腾出 MHCⅡ类分子结合沟,容许另一个外源性多肽装载于其上,最后,MHC分子加上多肽分子形成的复合物被转运至细胞表面展示。
大致过程就是这样,但仍有许多细节不明了。不过重要的一点是,机体为MHCⅠ类和Ⅱ类分子安排了两个独立装载位点和转运途径。正是装载位点和转运途径的相互独立,从而使得Ⅰ类“公告牌”可以为CTL公示发生在细胞内的事件,Ⅱ类“公告牌”为 Th公示发生在细胞外的事件。
虽说Ⅰ类和Ⅱ类途径相互独立是普遍的规律,但在特定实验条件下,由某些APC处理的抗原最终可被 MHCⅠ类分子提呈,这“违背”了细胞外抗原由 MHCⅡ类分子而不是 MHCⅠ类分子提呈的“法则”。这种 MHCⅠ类分子的“非法”展示,称为交叉提呈。迄今为止,大致交叉提呈的细节尚未明了,而且,在正常情况下,交叉提呈在人体内是否以某些可估量的频率发生,也尚未可知,因而,我们必须期待开展更多的实验,以确定交叉提呈是否预防被看作是“免疫系统如何运转”的一部分。
4.1.5 抗原提呈细胞
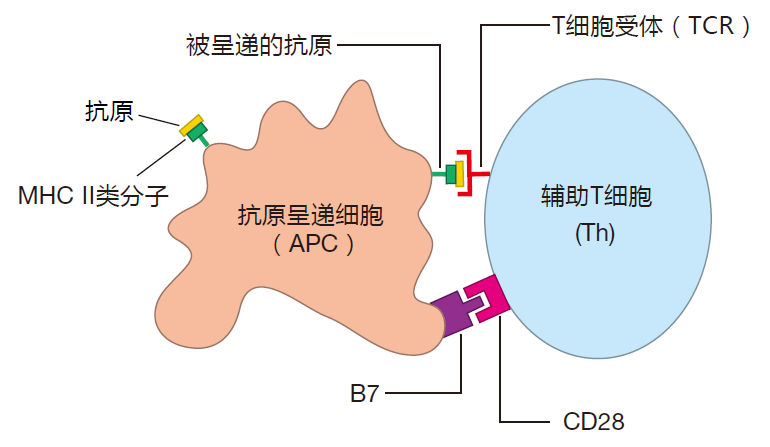
在CTL和Th细胞行使其功能之前,都必须被激活。为达到这一目的,T细胞必须识别由MHC分子提呈的同源抗原,但是仅此还不够。T细胞还必须接受第二共刺激信号。只有某些特定的细胞可装备能提供Ⅰ类和Ⅱ类MHC分子展示及共刺激的能力,这些细胞即为专职抗原提呈细胞。
因为抗原提呈细胞的工作职责就是激活CTL和Th,这些细胞更应该被称作“T 细胞激活细胞”。这可以避免与体内“普通”细胞相混淆,这些普通细胞不能激活T细胞,但是他们也利用MHCⅠ类分子提呈细胞内产生的抗原,以警示CTL。
说得更明了一些,请记住:术语“抗原提呈细胞”通常指一些特殊细胞,它们能提供T细胞激活所需的高水平的MHC分子和共刺激信号。
共刺激过程通常涉及到抗原提呈细胞表面的B7蛋白,B7蛋白可以插入 T细胞表面CD28蛋白分子内。
迄今为止,三类抗原提呈细胞已被确定:激活的树突状细胞、激活的巨噬细胞和激活的B细胞。有趣的是,所有这些细胞均为白细胞,其生命起源于骨髓组织,出骨髓后迁移至机体各个部位,并且在其行使抗原提呈功能之前必须被激活。由于新的血细胞不断产生,抗原提呈细胞根据需要可得到再补充。
4.1.5.1 激活的树突状细胞(DC )
有关树突状细胞的故事十分有趣,因为直至数年前,人们对其还怀着一种好奇心,然而,当前的共识是:由于树突状细胞能通过激活原初T细胞而启动免疫应答,因此这些既往无名的细胞是最重要的抗原提呈细胞。其作用过程如下。
最先被描述的树突状细胞是海星状的“朗罕细胞”,这是一种仅发现于皮下组织的细胞,然而,随后发现树突状细胞定位于全身各部位。已清楚的是,树突状细胞作为哨兵细胞,守卫着上皮细胞屏障之下的部位。在正常组织中,树突状细胞为重量级吞饮者,它们每小时可吸收4倍于其体积的细胞外液。通常,它们仅只是把细胞外液吞饮进去,然后将其吐出细胞外。在这一静息状态,树突状细胞表面表达有一些B7分子和相对低水平的MHC分子。因此,静息态树突状细胞不擅长于提呈抗原至T细胞,尤其不擅长于将抗原提呈至原初T细胞——提呈抗原至原初T细胞要求有MHC-多肽复合体及强有力的共刺激介导的大量受体交联。
一旦有微生物入侵,树突状细胞定居的组织将成为战场,这一“重量级吞饮者”的生活方式因被激活而将发生显著的改变,这一情况发生于当树突状细胞表面的受体识别微生物入侵者的特征性分子(如革兰氏阴性菌的 LPS)或能提供信号提示先天免疫系统正忙于战斗的细胞因子时。例如,当战斗性巨噬细胞所分泌的TNF结合于树突状细胞表面的受体时,吞噬作用结束,随之发生的事情是树突状细胞离开组织,经由淋巴系统迁移至最近的淋巴结。正是这种“一经战斗信号刺激即游走”的能力使得树突状抗原提呈细胞如此特别。
在静息状态树突状细胞内有大量的 MHCⅡ分子正等候着被装载。当静息树突状细胞被激活时,这些“储备”的MHCⅡ分子与来自战区的抗原装载。当树突状细胞抵达目的地时,这些装载抗原的 MHCⅡ分子被展示于树突状细胞表面。
同时在游走过程中,树突状细胞上调 MHCⅠ类分子的表达。因而,当树突状细胞在战区被病毒或寄生物感染时,由这些侵袭寄生物产生的蛋白片段可以在淋巴结中由MHCⅠ类分子有效提呈,最后,在移行过程中,树突状细胞也增加B7共刺激蛋白产生。所以,当抵达淋巴结时,游走树突状细胞已具备激活原初T细胞所必需的一切条件——高水平的MHCⅠ类和Ⅱ类分子及足够量的B7蛋白。
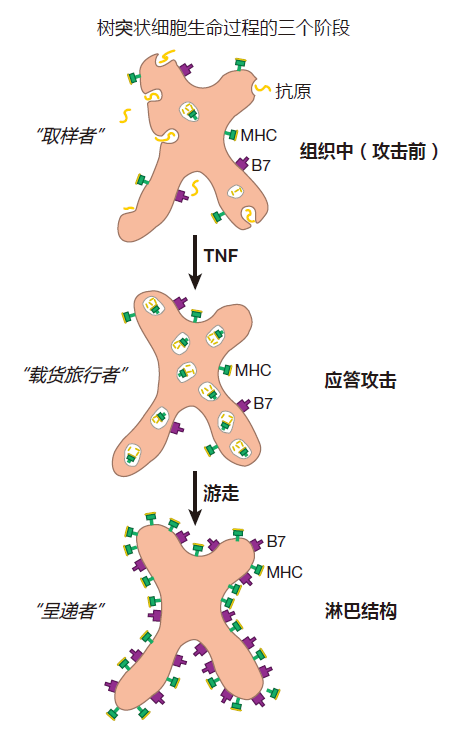
现在,你知道为什么树突状细胞在组织中大量获取抗原标本,而当它们开始向淋巴迁移时即终止其“取样”会是一个好主意了吗?当然。树突状细胞以“快照”形式抓拍正在前线发生的事情,并把这些音像带至淋巴结,在这里它们激活原初T细胞,而原初T细胞的受体可识别“照片”上的入侵者。由于淋巴结是T细胞经常去的“约会酒吧”,游走的树突状细胞可以将从战区携带的可以带至原初T细胞的聚集点,而诸如TNF等细胞因子可激发树突状细胞迁移至淋巴结,这一现象同样也十分有意义。总而言之,只要战斗还在继续,机体就需要DC 游走并提呈抗原。
当国家安全遭受威胁时,我们的国防部门必须作出回应,此时应遵从“相称反应原则”。例如,如果恐怖分子攻击我们的某个大使馆,我们不会反击投放原子弹,我们会根据这一局限的攻击作出恰当的反应。同样地,免疫应答的强度要与遭受攻击的严重程度相称,这也是很重要的。幸运的是,免疫系统正是基于这一原则设计出来并进行工作的。下面我来作一解释。
当细胞因子激活树突状细胞后,树突状细胞只迁移至临近的淋巴结。如果感染严重,产生大量的细胞因子,就会有大量的树突状细胞开始迁移。而且,在离开组织之前,树突状细胞产生特殊的细胞因子(亦称趋化因子)来影响前体细胞(单核细胞),使其离开血液,进入组织,且成为树突状细胞。因而,激活的树突状细胞可募集自身替代者。这些新抵达的树突状细胞继而被激活,并被派遣至淋巴结,从而扩大了针对入侵的免疫应答。另一方面,如果攻击相对温和,则战斗性细胞因子的产生相对较少,相应地,也有较少的树突状细胞参与游走,替换补充者也较少。由于在淋巴结中被激活的B细胞和T细胞的数量取决于携带有战斗信息的树突状细胞,因此建立了一个“惩罚措施与犯罪行为相适应”的系统,使免疫应答的强度取决于感染的严重性。
一旦激活(免疫学家通常称其为“成熟”)的树突状细胞抵达淋巴结,它们仅存活数天,乍一看,这一短暂的寿命似乎不可思议,毕竟,几天的时间不足以使树突状细胞较长时间地与原初T细胞会面(接触),而这些原初T细胞正循环于淋巴结之间,寻求其同源抗原。但是,这一短暂的“提呈”寿命确保了由树突状细胞所携带的战斗“信息”总是最新的。实际上,由于树突状细胞募集自身替换者,如果战斗持续进行,更多的树突状细胞将被激活,携带新的战斗信息至淋巴结。而且,当入侵者被制服,DC即结束游走,成熟树突状细胞的短暂寿命使得免疫系统更容易回复到为应答状态。
因而,树突状细胞是组织中哨兵细胞,如果有入侵,DC将被激活,并游走至最近的淋巴结。此处,它们通过将从战区收集到的抗原提呈给原初T细胞,激发获得性免疫应答。激活的DC寿命很短,DC快速更新确保其携带至淋巴结的“信息”是最新的。而且,从组织中派遣出来的树突状细胞和替换补充的树突状细胞数量将取决于受攻击的严重程度。因而,针对入侵引发的危险,免疫系统能够组织起相对应的应答水平,你还能想像出比这更精巧的抗原提呈系统吗?我想不能。
4.1.5.2 激活的巨噬细胞
巨噬细胞也是守卫机体暴露于外界部位的哨兵细胞。它们是适应能力非常强的细胞,根据所接受的来自其定居微环境的信号而具有多种功能,如垃圾收集、抗原提呈或强大的杀伤功能。在静息状态,巨噬细胞擅于清理保洁,而不十分擅于提呈抗原,这是因为巨噬细胞只有被战斗性细胞因子如 IFN-γ等激活后,才表达足够水平的MHC和共刺激犯罪,发挥其抗原提呈细胞的功能。
因而,如同树突状细胞一样,只有当值得提呈的某种危险信号存在时,巨噬细胞才能有效地提呈抗原。然而,不同于树突状细胞的是,巨噬细胞并不游走。DC可被描述为“摄影记者”——拍摄快照以获取信息,然后离开战区,去编辑它们的故事;而巨噬细胞则总是像士兵一样,必须站岗、战斗。毕竟,在抵抗入侵者的早期过程中,巨噬细胞是主要武器之一。巨噬细胞缺乏游走能力为我们提出了一个有趣的问题:如果激活的巨噬细胞不能游走至原初T细胞定居的淋巴结,那么它提呈抗原的优势何在?
一旦被树突状细胞激活,T细胞离开淋巴结,进入炎症部位,协助战斗,但是,这些活化的T细胞必须连续不断地被再刺激,否则它们会认为已经赢得战争并回到静息态或自生自灭。此时激活的巨噬细胞走上舞台,它们在组织中扮演了“加油站”的角色,通过保持有经验的T细胞被激活,使它们持续参与战斗。因此,树突状细胞在淋巴结激活原初T细胞,而在战场外,激活的巨噬细胞的主要功能是再刺激有经验的T细胞。
4.1.5.3 激活的B细胞
第三类专职APC是激活的B细胞,由于仅表达低水平的 MHCⅡ类分子及很少或几乎不表达B7,原初B细胞并不擅长抗原提呈。但是,B 细胞一旦被活化,其表面MHCⅡ类分子及B7分子水平显著上升,因而有经验的B细胞能够为Th细胞扮演抗原提呈细胞的角色。目前认为在感染的原初阶段B细胞不能作为APC,因为当时它们还处于原初阶段,尚未被激活,但是,在感染后期或继发感染过程中,由有经验的B细胞介导的抗原提呈起着重要的作用。实际上,与其他APC相比较,B细胞具有一个很大的优势,它可以浓缩抗原以提呈,其作用过程如下。
B细胞数天与同源抗原结合后,BCR与抗原形成的整个复合体移离细胞表面,进入细胞内,随后抗原被加工,装载于MHCⅡ类分子上,并进而转运回细胞表面提呈。
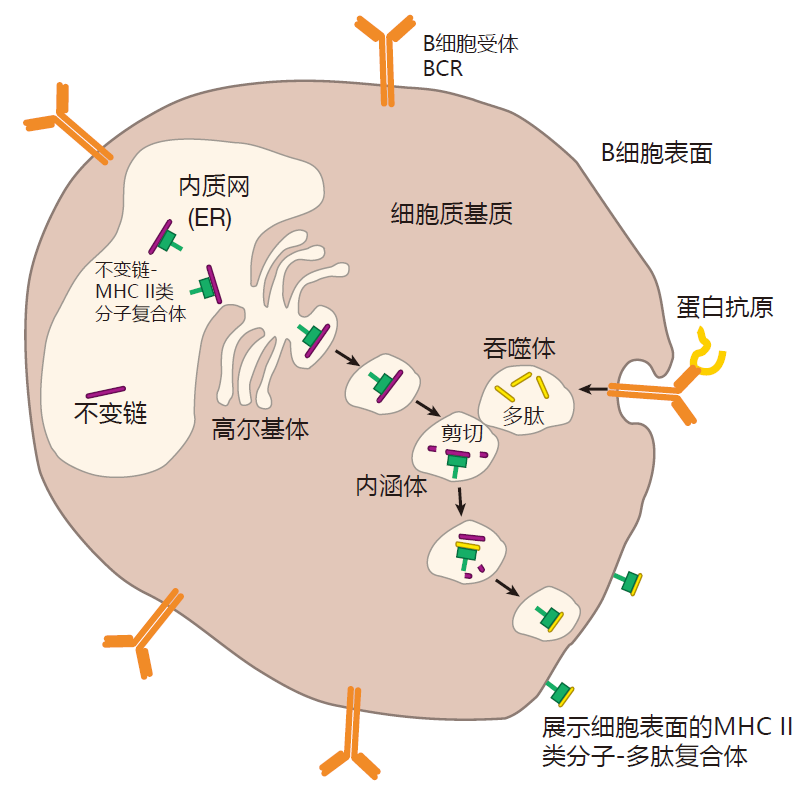
由于BCR对抗原具有很高的亲和力,这些受体有如“磁铁”,富集抗原并提呈至Th细胞。既然在Th细胞被活化之前,一定阈值量的T细胞受体必须与所提呈的抗原交联,因此当周围抗原量相对很低时,B细胞在激活Th 的过程中,要100-10000倍优于其他APC。而且由B细胞介导的抗原提呈过程也十分迅速,从抗原被B细胞受体捕获直至由 MHCⅡ类分子介导抗原被展示于细胞表面。该窗口期不超过半小时。
综上所述,当首次遭遇入侵者时,能识别入侵者的所有B细胞均为原初 B细胞,此时重要的APC是激活的树突状细胞。接下来,当战斗越来越激烈时,激活的巨噬细胞离开前线,提呈抗原至作战T细胞,使其保持“打满气加足油”状态;随后,如果再次遭遇同样的入侵者,首次攻击后余留的有经验的记忆B细胞成为最重要的 APC,因为它们能通过对少量抗原进行浓缩快速推进获得性免疫应答。
4.1.6 MHC提呈的合理性
为了真正地鉴赏抗原提呈之所以是造物主最伟大的发明之一,我们有必要对这一令人惊异的过程背后所蕴藏的神奇背景作一番探讨。首先有这样一个问题:究竟为什么MHC提呈如此重要?为什么T细胞受体不能识别未被提呈的抗原,而B细胞受体却能这样做?这确实是一个由两部分组成的问题,因为我们谈论的是两个完全不同的提呈过程:Ⅰ类和Ⅱ类展示。所以,我们将两种展示过程分别予以讨论。
无疑,Ⅰ类提呈的根据之一是将CTL 注意力指向受感染的细胞,而不针对血液及其他组织中机体细胞外的病毒和其他病原体。只要病原体仍存留在细胞外,抗体就能对其作标记,由专职吞噬细胞进行摧毁,抗体还能与病原体结合阻止其引发新的感染。每一个浆细胞每秒钟能泵出一万个抗体分子,而这些抗体可作为“廉价”武器,能高效处理细胞外入侵者。但是,一旦微生物侵入细胞内,抗体对它就无能为力了。CTL是专门设计用于处理受感染细胞的“昂贵”的高科技武器。CTL识别受感染细胞表面由 MHCⅠ类分子提呈的抗原,可以确保 CTL不会浪费时间来追逐还在细胞外的入侵者。
另外,如果未提呈的抗原发出信号指使T细胞杀伤,这将是极端危险的。
可以想像,如果未受感染的细胞表面碰巧被死病毒碎片所粘附,而CTL 识别该未被提呈的可以,并杀死这些“无辜旁立者”细胞,这将是一件多么恐怖的事件,当然,这种情况一般不会发生的。
Ⅰ类展示之所以如此重要,还有另外一个理由,受病原体感染的细胞产生的绝大多数蛋白仍留在细胞内,并且从来不会自行跑到细胞表面,如果没有Ⅰ类展示,受病原体感染的细胞将不会检测出来。事实上,MHCⅠ类展示部分的神奇之处在于,理论上,入侵病原体的每一个蛋白都可被切割并由MHCⅠ类分子展示。
最后,由于其受体识别尚未切割加工和提呈的天然抗原,B细胞实际上处于一种劣势。原因在于绝大多数蛋白质必须被正确折叠,才能发挥其功能。而许多能被B细胞受体识别的靶分子位于折叠后的蛋白质分子之内,不能得到有效的查验。与此相反,当蛋白质被切割成短小片段并被MHCⅠ类分子提呈后,其表位就不能避开杀伤性T细胞。
因此,MHCⅠ类提呈具有多层意义,那么,Ⅱ类提呈又当如何呢?辅助T细胞该不会仅识别未被提呈的抗原吧?毕竟它们不是杀手,也就不存在旁观者杀伤的问题。确实是这样,但是这里仍有一个安全问题。因为APC只在战斗持续进行时才有效提呈抗原,不论是辅助T细胞,还是APC都必须“认识”到,在辅助T细胞被激活之前,还存在一个难题。通过使辅助T细胞仅识别被提呈的抗原,造物主确保获得性免疫系统的部署决策不是由单一细胞决定的。
与Ⅰ类分子一样,Ⅱ类分子也是提呈蛋白质短小片段。因此,在提呈抗原过程中,能被辅助T细胞所识别的靶分子数目远远超过能被查验的折叠蛋白质。
靶分子数目的扩展,导致了一个更强大、更多样的免疫应答,在该过程中,许多不同的辅助T细胞被激活,其T细胞受体识别每个入侵者的不同抗原表位。因而,利用MHC分子提呈抗原十分有意义。但是,为何造物主使MHC分子具有如此多样性?毕竟,人群如此多样,以至于我们中大多数人都继承了6种不同的Ⅰ类分子基因。这似乎有一点多了吧?我的意思是,为什么不让每个人都表达同样的 MHCⅠ类分子?
假设我们只有一种 MHCⅠ类基因,且对每个人来说该基因是相同的。如果一种病毒发生变异,以至于其多肽分子没有一个能与单一的MHCⅠ类分子结合。因为没有杀伤性T细胞能被激活以破坏病毒感染的细胞,这样一种病毒就能消灭整个人类。因此,MHC分子多态性至少能给一些人一个机会,在面对变异性强的病原体攻击时能存活下来。而且,我们每一个体都可能“拥有”多达6种不同的 MHCⅠ类分子,这使得我们每个个体至少拥有一种MHCⅠ类分子可与特定病原体蛋白质片段相匹配的可能性增加。实际上,最近的研究表明,遗传了最多数目的不同MHCⅠ类基因(6种)的AIDS患者平均存活时间显著高于仅遗传了5种或更少 MHCⅠ类基因的患者。该研究认为,随着AIDS病毒的突变,拥有更多数目的不同MHCⅠ类分子增加了突变病毒蛋白被提呈的可能性。
如果拥有6个MHCⅠ类分子很有好处,那么拥有1000个岂不是更好吗?
甚至为什么不是10000个?毕竟,造物主本可以利用基因片段混合和配对策略,使我们的MHC分子如同B、T细胞受体一样呈现多样性。但是它并没有这样做,并且有一个很好的理由。
假设某个“超人”不是拥有6种MHC分子,而是拥有了1000种不同的MHCⅠ类分子。由于T细胞受体不仅必须识别提呈的多肽,而且还必须识别专门从事抗原提呈的MHC分子,超人的每一个T细胞将只识别由 1000个MHC分子中的某一个提呈的多肽。而你的每个抗原提呈细胞平均有100000个MHC分子。
结果是超人的每一个T细胞上的T细胞受体只识别大约100个MHC分子。对一个将被激活的原初T细胞而言,约为100个T细胞受体必须识别一个特定的MHC-多肽复合物,因此,如果超人的APC表面每一类MHCⅠ类分子都提呈不只一种抗原(MHC分子通常可提呈数千种抗原分子),那么将几乎没有任何一类MHC分子能提呈一种特定抗原,以至于不能激活任何一个T细胞,在这种情况下,因为没有激活的T细胞,超人很可能变为死人。这里有一些微妙的机制可以阻止事态向这一更糟的态势发展,但要记住,由于具有1000种不同的 MHC分子,展示将非常弱以至于不能有效激活T细胞。我不知道为什么造物主只选了6种MHC分子。但我猜想这一定是某种妥协的结果。
综上所述,针对摆在免疫系统目前的许多问题,由MHC分子介导的抗原提呈是一个很好的解决方案:MHCⅠ类分子介导的抗原提呈可确保杀伤性T细胞专注于受感染的细胞,而那些无辜的旁立者不会被错杀,还可以确保不会让一个变异性强的病原体通过将其所有的蛋白质隐藏在细胞内而躲藏起来。由于将隐藏于折叠蛋白内的抗原表位显露出来,蛋白质片段的MHC提呈显著增加了能被杀伤性T细胞和辅助T细胞识别的抗原范围。由于MHC分子的这种多态性,很有可能某些人种具有能展示任何病原体蛋白片段的MHC分子。最后(或许是最重要的),辅助T细胞和杀伤性T细胞在活化前必须识别由APC提呈的同源抗原,在激活过程种,通过抗原提呈环节必要条件的设置,建立了一套自动保险相同,以使激活获得性免疫系统的决策永远不会由单个细胞作出。
4.1.7 MHC蛋白与器官移植
除在抗原提呈过程中发挥“自然”功能之外,MHC分子在组织和器官移植“非自然状态”下,同样具有重要意义。移植研究实际上起始于20世纪30年代的小鼠肿瘤相关实验。在当时,往往通过小鼠皮肤上擦拭一些有毒化学试剂而诱导肿瘤发生,然后等待很长一段时间让其发展。由于诱导肿瘤非常麻烦,生物学家希望在小鼠死亡之后,仍能使肿瘤细胞保持存活状态用于研究。他们将肿瘤细胞注射至另一只健康小鼠,在该健康小鼠体内肿瘤细胞仍能继续生长。然而,他们观察到这样一种现象:这样当两只小鼠来自结果许多次近亲繁殖的近交系小鼠时,肿瘤细胞才能被成功地移植;近交程度越高,移植存活机会越大。正是该研究推动了许多近交系小鼠的产生,免疫学家至今还在使用。正如你所知道的,只有通过连续繁殖,耗时两年多才能生产出真正的近交系小鼠,而系内小鼠基本上具有相同的遗传背景。
有了近交系小鼠后,免疫学家开始进行小鼠间正常组织的移植研究。他们很快发现,如果将供体小鼠的一小块皮肤组织移植到另一小鼠上,只要两只小鼠来自同一近交系,被移植新皮保持其健康的粉红颜色,并能继续生长;相反,当在非近交系小鼠身上开展同样实验时,被移植皮肤在几小时之内变白(提示血液供应中断),并最终坏死。免疫学家认为该即刻移植排斥反应一定是由于某些遗传不相容所致,因为在具有相同基因的近交系小鼠身上不会发生该现象。为了确定与“组织相容性”有关的基因,免疫学家通过培育近交系小鼠,产生近相差个别基因的小鼠品系,然而组织移植时仍表现为不相容。只要开展这些实验,免疫学家就一直试图对小鼠 17号染色体上基因复合体进行鉴定,他们最后称该复合体为“主要组织相容性复合体”,即 MHC。因此,我们在抗原提呈中所讨论的MHC分子与影响被移植物即刻排斥反应的分子是相同的。杀伤性T细胞对“外源”MHC 分子非常敏感,一旦识别“外
源”MHC分子后,CTL便攻击、杀死表达该“外源”MHC分子的细胞。CTL最偏好的靶细胞解释那些供体器官内血管组成细胞。通过破坏血管,CTL切断移植器官的血液供应,结果通常导致其坏死。为此,移植学家力图使供体与受体相匹配,使其具有相同的MHC分子,当时,找到这样一种匹配是很困难的,据估计,如果在 10000个与你无亲缘关系的个体骨髓捐赠库内寻找,找到与你的MHCⅠ类分子相匹配的概率只有70%。因此,MHC分子的多样性在保护我们免受新入侵者攻击过程中具有十分重要的意义,但提示也对器官移植产生了新的问题。如果当初造物主知道我们将进行器官移植,或许她就不会制造出如此多样的MHC分子了。
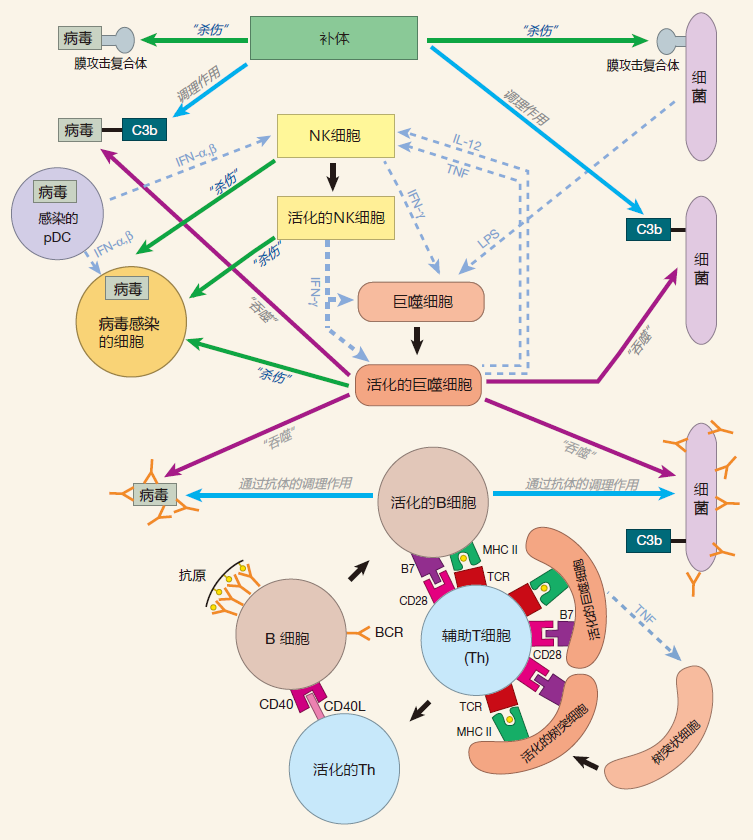
4.2 总结图
既然你已经知道是如何被提呈的以及为什么由MHCⅠ类和Ⅱ类分子来介导传递?我们有必要将注意力移向那些“核查”两类抗原提呈过程的细胞——辅助T细胞和CTL。这些细胞是如何与被提呈抗原相互作用的,将在下一讲中加以讨论。
下图包含了抗原提呈细胞及其MHC 和B7分子。