5 T细胞和细胞因子
5.1 T细胞和细胞因子
在这一讲中,我们加工着重讨论T细胞是如何被激活及它们的作用是什么?首先,我们谈谈TCR,这些分子位于T细胞的表面,并作为细胞的眼睛观测世界。没有这些受体,T细胞就会变盲,而无法感知外界发生的一切。
5.1.1 T细胞受体
T细胞受体有两种——αβ和γδ。每一型受体由两种蛋白组成,即α和β或γ和δ。就像B细胞受体的重链和轻链一样,α、β、γ和δ的基因都是由混合配对的基因片段组合起来的。实际上,无论是T细胞还是B细胞中,均由同样的蛋白(RAG1和RAG2)通过在染色体DNA上形成双链缺口而起始基因片段的剪接。因为基因片段是混合和配对的,“竞争”的结果导致每一个T细胞都只包含一个αβ或一个γδ受体,而不会两者兼备。一般来说,一个阐述T细胞上的所有TCR都应该是一样的,尽管有时这个规则也会出现例外。
大约有超过95%循环中的T细胞具有αβ型T细胞受体,此外,出了αβ蛋白外还表达一个CD4或CD8共刺激分子。与之相对,绝大多数γδ型T细胞不表达CD4或CD8。含γδ受体的T细胞在与外界接触的区域如肠道、子宫、舌部富集。
有趣的是,鼠类皮肤表皮层还有很多γδ型T细胞,但人类皮肤却不含,这提示我们,对于免疫系统而言,不能简单地将人类仅仅作为放大的老鼠。
尽管αβTCR可以认为和BCR一样具有多态性,然而γδ型受体却要少一些。
例如,舌部和子宫的γδ型TCR在重排过程中偏好于一些特定基因片段,而肠道的γδ型受体却更偏好另一些经营平等的组合。这使人们联想到,作为先天免疫系统的成员,γδ型T细胞站在“前线”守望,它们的受体识别由特定位点入侵的侵略者。
对于γδ型T细胞现在仍有许多未解之谜。比如,人们不清楚这些细胞如何“被训练”的?αβ型T细胞在胸腺中受训,被“告知”不要与我们的自身肽段发生反应。
尽管γδ型T细胞同样存在于胸腺中,缺乏功能性胸腺的裸鼠仍可以产生γδ型T细胞。在大多数情况下,人们不能确切知道什么是γδ型T细胞所识别的?但可以确信的是,就如B细胞一样,γδT 细胞对未提呈的抗原感兴趣。最后,尽管γδ型T细胞中的部分因为受微生物感染的刺激而成为受伤细胞,但其确切功能目前还不明了。
由于目前已经对αβ型T细胞研究得较为清楚,我们接下来将着重讨论这些细胞。αβ型受体识别细胞表面肽和 MHC分子的复合物。这里所说的 MHC-肽复合物是一段结合于MHC 分子结合沟内的肽,用复合物来强调TCR识别的是肽和MHC 分子两者这样一个事实。一个特定T细胞所拥有的受体是只能识别与MHCⅠ分子或 MHCⅡ分子相连的肽段,而不是两者都识别。
5.1.2 一个T 细胞受体是如何传递信号的?
一旦TCR识别了由 MHC分子所提呈的同源抗原,进行接下来就应该将 T细胞表面发生识别的信号传递至T细胞核内。也就是说,为了使T细胞从静息状态转换入激活状态,必须改变基因的表达,而这些基因当然是位于细胞核内的。
通常而言,这一跨膜信号传递涉及一个含胞外区和胞内区两部分的跨膜蛋白,其中胞外区结合细胞外的分子(即配体);胞内区启动生物信号级联效应,将“配体结合”的信号传递至核内。在此,TCR遇到一个问题,就像BCR一样,αβ型TCR有一个非常完美的胞外区可以结合它的配体,但是α和β蛋白的胞质尾部只有大约 3个氨基酸的长度,这对于信号传递来说太短了。
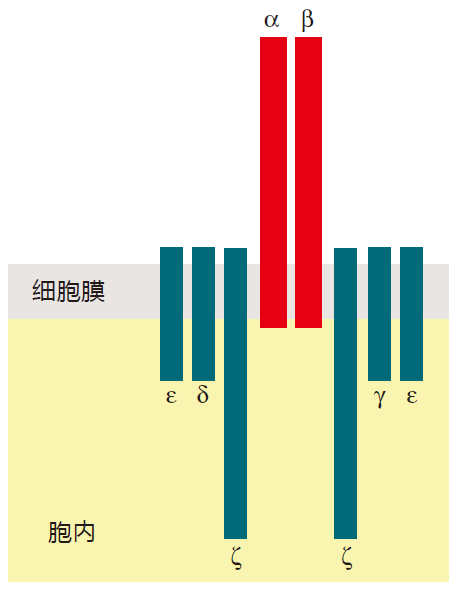
为了便于信号传递,造物主给TCR加了铃和哨——一个通常被称作CD3 的蛋白复合物。人类的这一信号传递复合物由4个不同蛋白质组成,γ、δ、ε和ζ。然而,请注意,作为CD3复合物组成部分的γ和δ蛋白与组成γδ型T细胞受体的γ和δ蛋白是不一样的。CD3蛋白锚定在细胞膜上,拥有足够长的胞质尾部能够进行信号传递。与BCR一样,TCR的信号传递包括将这些受体在T细胞表面的某个区域簇集在一起。而后,一定数量的激酶通过CD3蛋白的胞质尾部被募集,激活的信号就这样被传递入核。
虽然关于这一信号传递的细节描述还稍显粗略,但关于T细胞受体这一六蛋白复合物 仍然有一些值得关注的地方。首先,整个复合物蛋白(α、β、γ、δ、ε和ζ)是作为一个单元被转运至细胞表面。如果这些蛋白的任一缺失,就不能在细胞表面形成TCR。所以大多数免疫学家认为,有功能的、成熟的TCR应该是整个的蛋白复合物。毕竟,虽然γ、δ、ε和ζ蛋白可以很好地传递信号,但它们对于细胞外发生了什么又是全盲的,所以需要蛋白复合物整体来完成信号传递。
回顾当初对TCR的α和β链的发现,当时认为TCR的功能仅只是作为一个on/off的开关来激活信号传递,但现在你已经知道了CD3蛋白,那么这还像一个简单的on/off的开关吗?绝不是,造物主当然不会用6 个蛋白来制作一个简单的on/off开关!应该说TCR是多才多艺的。它可以根据不同的方式、不同的时间、不同的 地点引发信号传递,从而导致不同的结果。例如,当在胸腺中受训时,如果TCR识别的是MHC及自身肽的复合物,此时T细胞受体通常就引发自杀(通过凋亡而死亡)。而后,如果TCR识别的是MHC分子提呈的同源抗原,但T细胞又没有接收到所需的共刺激信号,则T细胞就会变成中性(无反应性)而不能行使其功能。当然,如果保证了TCR所需的同源抗原和共刺激分子,则TCR 信号途径就被激活。所以,相同的T细胞受体,根据不同的情况,可以产生死亡信号、导致无反应性或导致被激活。实际上,已有报道改变提呈肽的单个氨基酸,就可以导致激活信号变为死亡信号。显而易见,这不是一个简单的 on/off开关,免疫学家正在非常努力地寻找答案,力求弄清关于TCR信号是如何被引发以及到底哪些因子影响了信号传递的结果。
5.1.3 CD4和CD8共受体
造物主是否需要CD4和CD8共受体呢?我的意思是,既然已经有α和β两种蛋白用于抗原识别以及四种蛋白γ、δ、ε和ζ作为信号传递。你不会认为情况就是这样的吧?当然不是了,免疫系统一定有一些本质的特征,使得对于CD4和CD8共受体是必需的,我们来看看是些什么吧!
杀伤性T细胞和辅助T细胞履行两种截然不同的任务,它们分别通过MHCⅠ类和MHCⅡ类这两类不同的分子获得不同的工作提示。但是,CTL 是怎样知道应该识别由 MHCⅠ类分子提呈的肽段,而Th细胞又是如何知道应该识别由MHCⅡ类提呈肽段的APC呢?毕竟,如果CTL 犯“糊涂”去识别APC上的MHCⅡ类-肽复合物并将该抗原提呈细胞杀死,绝不是一件好事!所以,这时就需要 CD4和CD8了。通常CTL表达CD8,而Th细胞表达CD4。这类共受体分子的作用是钳住MHCⅠ类(CD8)或MHCⅡ类(CD4)分子。
这些“钳子”可加强T细胞和APC之间的附着力,所以CD4和CD8共受体分子的作用就是通过适当的MHC分子吸附住CTL和Th细胞。但故事还要深入讲述下去,因为就像CD3蛋白复合物一样,CD4和CD8分子同样也是信号分子。CD4和CD8都具有可穿过细胞壁深入细胞内部(细胞质)的尾部,这些尾部也具有信号传递所必需的特性。此外,由于CD4 是一个单体蛋白,而CD8则是由两个不同蛋白所组成,因此,由这两个共受体分子所传递的信号可能完全不同,也就是可以用“辅助”和“杀伤”区分两者。相当于与细胞表面αβT细胞受体紧密黏合的CD3分子,CD4和CD8共受体分子通常只是与 TCR/CD3蛋白松散结合。最近人们认为,一旦TCR识别了由MHC分子提呈的同源抗原,CD4或CD8共受体分子就钳住TCR-MHC-肽复合物,并使其间相互作用稳定,从而加强了由TCR进行的信号传递。

当T细胞在胸腺中开始成熟时,在它们的细胞表面均表达两种类型的共受体分子,免疫学家称它们为 CD4+CD8+细胞。然而当它们成熟后,其中一种共受体分子的表达就会下调,从而一个细胞要么成为CD4+要么成为CD8+。那么,一个特定的T细胞又是怎样“决定”在它成熟以后,表达CD4还是CD8呢?对于T 细胞成为CD4+还是CD8+,免疫学家知道得并不比B细胞如何最终成为浆细胞还是记忆细胞更清楚。有观点认为T细胞下调其中一型共受体分子的表达只是一个随机过程,也有观点认为,如果TCR恰好结合至胸腺细胞表面的MHCⅠ类分子,就会传递出下调CD4表达的信号(指令模型)。虽然最近有实验支持指令模型,但也有实验对此提出了疑问,因此,关于T细胞如何对它们的共受体分子进行“精挑细选”仍然悬而未决。
5.1.4 共刺激
在原初T细胞中,T细胞受体和细胞核之间的联系并不是很健全。如果说 T细胞内有一个电子系统,那么似乎有一个巨大的电阻器存在于传感器(TCR)和调节设备(核内基因表达)之间。因为这个“电阻器”的存在,大量从TCR发出的信号在传送到细胞核的过程中丢失了。结果导致大量被抑制的TCR在信号传递入核、成熟足够强的影响效应前,就必须识别它的同源抗原。然而,一旦TCR参与,T细胞同样也会接收到共刺激,从TCR传出的信号就会被放大很多倍,因此,只需极少量(约 1/100)的TCR参与就可激活原初T细胞。所以,在激活前,除了原初T细胞的受体应与 MHC-肽结合外,还必须接收到共刺激信号。
共刺激就好像一个“扩增器”,可以用来放大由TCR发出的“我参战了”的信号,从而降低必须与MHC-肽复合物交联的TCR阈值。
有趣的是,一旦原初T细胞被激活,TCR和细胞核之间的联系就被巩固了。似乎有经验的T细胞被“再激活”就可绕过原初T细胞里的电阻器了。“再激活”所导致的结果是,在有经验T细胞中TCR信号的扩增不像其在原初T细胞中那样重要。因此,有经验T细胞对共刺激的需求较低。最近有实验描述了共刺激扩增TCR信号的机制,下面我们来介绍一下它是如何运作的。
虽然可以直观地将细胞表面当作一个刚性表面,但覆盖于人类细胞表面的质膜更像一个有粘性可流动的表面,而不是一个坚硬的壳。实际上,细胞表面的蛋白几乎是完全漂浮于这一油性粘液面上。值得注意的是,细胞膜的组成成分并不是完全均一的,一些特定的蛋白和特定类型的脂质分子形成了一个可称为“橡皮船(rafts)”的聚集体。免疫学家研究这些富含胆固醇的橡皮船时,发现它们包含大量的下游信号分子,这些信号分子通常将“TCR 参战”的信号西欧能够细胞表面携带入核。免疫学家还发现,一个原初T细胞被激活前,它的绝大部分T细胞受体都不与这些橡皮船相连,然而,一旦T细胞受体结合其同源抗原,TCR就与橡皮船联系起来,这使得TCR与下游信号分子紧密相连,从而可以完成向核内的信号传递。
在原初T细胞被激活前,其表面并不含很多的这类脂质橡皮船。它们中的大部分作为其他膜结构的组成部分存在于细胞内部。通常认为是由于细胞表面缺乏这些橡皮船,没有足够的“电波”(下游信号分子)可有效运载信号,而导致原初T细胞的TCR和核的联系不很通畅。然而,如果原初T细胞的受体结合其同源抗原,并且由APC提供适当的共刺激,细胞内部储藏的脂质橡皮船就会涌至细胞表面。这样,TCR 的信号就可以被与橡皮船相连的另外一些下游信号分子所运载,引发强烈的信号传递入核。
由此可以认为,共刺激引发的信号扩增的关键是共刺激募集脂质橡皮船至T细胞表面。与这一模型一致的是,有经验的T细胞较原初T细胞在细胞表面有更多的“橡皮船”。因此可以预测,因为有经验的T细胞的“橡皮船”已经位于细胞表面,随时等待运载信号,故其重新激活并不需要像初始激活原初T细胞那样强烈的共刺激。
虽然目前已经分离出了很多不同的T细胞共刺激分子,但其中研究最清楚的是表达于APC表面的B7蛋白(B7-1 和 B7-2),B7 蛋白可以通过插入T细胞表面的受体而对T细胞提供共刺激。迄今为止已分离出了这类受体中的两种——CD28和 CTLA-4。大部分T细胞表达 CD28 蛋白,而 CTLA-4分子只在激活的T细胞中表达。现在认为,APC上的B7蛋白通过与原初T细胞的CD28受体结合,而提供激活所必需的共刺激信号。随后,一旦细胞被激活,B7蛋白与CTLA-4 受体结合就可促使关掉或“去活化”T细胞。获得性免疫应答行使完其功能后对其实施关闭是非常重要的。否则,我们体内的激活B细胞和激活T细胞就只能帮助我们防御过去的敌人,而不能抵抗现在和将来的入侵者。利用CTLA-4 结合作为T细胞激活的负调节机制之一,可以帮助我们实现这一目的。
5.1.5 辅助T 细胞激活的缩时影像
我敢打赌,你对辅助T细胞激活过程的印象是这样的:淋巴结中的树突状细胞从原初T细胞上空掠过并激活它们。我以前也是这么认为的,然而,现在已证实原初辅助T细胞的激活需要数小时。虽然到底需要几小时现在还存在争论之中,但可以肯定的是“掠过”并不是树突状细胞的行为。
在激活原初T细胞的数小时内,有一些很重要的事情发生。首先,树突状细胞表面的黏附分子结合到其在T细胞上的粘附伴侣上,从而将两个细胞连在一起。这种尼龙搭扣样(Velcro-like)的相互作用是非特异性的,反应也不强烈,但给辅助T细胞的TCR提供了一个机会,使其可以扫描识别APC表面的MHC-肽复合物。如果TCR不能识别其在树突状细胞“公告牌”上的同源抗原,相应细胞及TH细胞就会继续来扫描其他的 APC。
然而,如果辅助T细胞的TCR找到了与之相匹配的分子,T细胞表面的 CD4共受体分子就会钳住树突状细胞上的 MHCⅡ类分子,从而加强了两个细胞间的相互作用。另外,TCR 的参与上调了Th细胞表面的黏附分子表达,因此会有更多的黏附分子参与连接,从而加强了APC和T细胞之间的黏合。这是非常重要的,因为TCR和MHC-肽复合物之间的连接本来非常脆弱。黏附分子保证了APC和T细胞长时间连在一起,以达到一个足以启动TCR参与的阈值。而实际上,APC 表达黏附分子的能力是将其与“普通”细胞区分开来的一个特征。APC和T细胞接触点上的TCR与黏附分子“簇”构成了被免疫学家称为“免疫突触(immunological synapse)”。
辅助T细胞受体的参与同样也在T细胞表面上调了CD40L蛋白的表达。当这些蛋白插入树突状细胞表面的 CD40蛋白后,就会发生一些非常的事件。尽管树突状细胞以表达MHC和共刺激分子(如B7)的“成熟状态”进入淋巴结,然而当APC上的CD40 蛋白结合了T细胞上的CD40L蛋白是,MHC和共刺激分子的表达水平就会增加。树突状细胞CD40蛋白的参与同样也会引起细胞分泌细胞因子(如 IL-12),并延长树突状细胞的寿命,这种对有用树突状细胞生命的延长具有非常重要的意义,可以确保那些可顺利与原初T细胞间发生相互作用的(也就是可提呈T细胞同源抗原)树突状细胞有足够长的时间来激活大量的T细胞。
所以,树突状细胞与原初辅助T细胞间的相互作用并不只是有一种方式。这些细胞在彼此激活时执行的是一种激活“舞蹈”。舞蹈的结果使树突状细胞成为一种更具潜力的抗原提呈细胞,而TH细胞则被激活表达高水平的CD40L,后者对于辅助激活B细胞是必需的。
激活过程完成以后,辅助T细胞和抗原提呈细胞就分开了。APC继而进一步激活其他T细胞,而新激活的TH细胞则通过增殖建它们的数量群,生长因子如IL-2促成了这一增殖过程。原初T细胞可以分泌一些IL-2,但在其表面没有IL-2 受体,所以它们自身不能与这种细胞因子反应。然而,当Th细胞被激活后,其表面就会出现生长因子受体,这些细胞开始分泌更多的IL-2。结果,新激活的辅助T细胞可以刺激自身的增殖,大概每6 小时就可使自身群体的数量倍增。
对于克隆选择来说,这种伴随生长因子受体上调的激活是必需的:被选择激活的Th细胞(由其TCR识别入侵者)上调其细胞因子受体,并增殖形成克隆。
因此,激活一个辅助T细胞的顺序是:当TCR与APC提呈的同源抗原结合时,由黏附分子介导Th细胞和 APC之间形成不牢固的结合;受体的参与加强了两种细胞间的粘附力,并上调TH细胞的CD40L表达;CD40L 继而结合至APC表面的CD40,并刺激APC表面MHC和共刺激分子的表达;APC提供的共刺激可以放大“TCR 参与”的信号,使激活过程更为有效;当激活过程完成之后,结合于TH细胞表面受体的生长因子驱使TH细胞增殖。
5.1.6 TH细胞分泌的细胞因子
原初辅助T细胞首先被激活后,它们分泌的主要细胞因子是IL-2。一旦 Th细胞增殖,形成由同样的细胞聚集成的克隆,它们必须被APC重新激活,分泌其他细胞因子如 IFN-γ、IL-4、IL-5、IL-10 和 TNF。一般来说,单个TH细胞不能分泌所有的这些细胞因子。实际上,Th细胞更趋向于分泌可能的细胞因子亚型,这些细胞因子亚型可以归为两类:Th1 亚型,包括 IL-2、IFN-γ和 TNF;Th2亚型,包括 IL-4、IL-5δ和 IL-10。
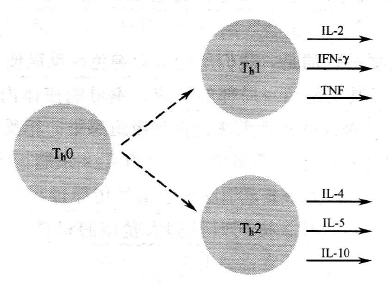
当然,Th 细胞分泌的细胞因子并不仅仅只有这两大亚型。实际上,免疫学家最初用了很长时间发现人类辅助T细胞分泌的Th1和Th2亚型细胞因子。很明显,也有TH细胞分泌混合的细胞因子,既不能将其归为 Th1亚型,也不能归为 Th2 亚型,但弄清Th1和Th2型的概念对理解TH细胞分泌的细胞因子混合物是非常有用的。
那么,为什么不同TH细胞分泌不同亚型的细胞因子是极为有意义的呢?让我们来回顾一下组成Th1和 Th2 亚型的细胞因子功能,就会很容易理解造物主为什么要这样做了。
经典的Th1型细胞因子包括 IL-2、IFN-γ和 TNF。IFN-γ是一种可以致敏巨噬细胞、并在可以类别转换时影响B细胞分泌IgG3抗体的细胞因子,而IgG3对于调理病毒和细菌及固定补体分泌极为有益。TNF 可以激活致敏巨噬细胞和自然杀伤细胞,IL-2则是刺激CTL和NK细胞增生的细胞因子。所以Th1型细胞因子因其可以引导先天免疫系统和获得性免疫系统产生对抗病毒和细菌特别有效的细胞和抗体,故可以作为血液和组织中抵抗病毒和细菌感染一组完美的成分。
接下来我们看一看Th2型细胞因子。IL-4是B细胞生长因子,同样也可影响B细胞的抗体类别转换,从而诱导其分泌IgE 抗体。IL-5可以促进B细胞分泌IgA抗体。所以Th2型细胞因子可作为一种许可证,在机体需要它们是可以促使产生大量的抗体抵抗寄生虫(所产生的抗体为IgE)或黏膜感染(所产生的抗体为IgA)。
作为免疫系统这一“球队”的“四分卫”,辅助T细胞可以通过分泌指导免疫反应的细胞因子而“召集球员”。通过分泌合适的细胞因子,Th细胞可以帮助形成应对特定入侵者的适当的免疫应答——如此地因地制宜。
这里特别需要一提的是,我们所指的影响免疫反应使之偏向于Th1或Th2型细胞因子,其实是相当局部的反应。不可能使体内的每一个TH细胞都变成Th1型,否则就永远无法抵抗呼吸道感染。相反,也不可能只拥有Th2 型细胞,因为一旦感染了细菌,此时由Th2细胞因子产生的IgA或IgE抗体将毫无用处。
实际上,细胞因子信号传导过程中所拥有的局部特性,使免疫系统拥有弹性,可同时抵御大量威胁机体不同部分的众多入侵者。
5.1.7 树突状细胞作为免疫系统球队的“ 教练”
我们已经知道辅助T细胞通过细胞因子来指导免疫反应。然而,这些“四分卫”细胞是如何知道对于一种特定情形哪种细胞因子适用呢?做出分泌合适细胞因子的正确决断,至少需要两方面的信息。首先,必须知道免疫系统正在面对的是哪种入侵者,是病毒、细菌,还是寄生虫?其次,必须确定入侵者侵入了机体的哪一部分,它们是位于呼吸道、消化道还是大脚趾?原初辅助T细胞不能直接获取这些信息、毕竟,它们忙于在血液和淋巴结中不断巡游,寻找其同源抗原。
这时需要一个“观测员”,它应确实位于“战场”上,收集相关信息并将其传递给辅助T细胞。那么,哪种免疫细胞具有成为这样一个“观测员”的资质呢?当然是树突状抗原提呈细胞了。
就像一个足球队的教练收集对手信息、拟定作战计划一样,树突状细胞作为免疫系统球队的“教练”,也同样要收集关于入侵的信息,并决定免疫系统要怎样地产生反应?这就是树突状细胞显得如此重要的原因。它们不止是激活辅助T细胞和杀伤细胞,它们实际的功能是作为免疫系统的“大脑”,加工处理所有关于入侵的信息,并制定一个作战计划。
什么样的“输入信息(input)”是树突状细胞要整合并制定作战计划的呢?免疫学家已确定了树突状细胞在“战场”外实际的两种不同类型的情报,第一类型的输入是通过直接或间接识别各种入侵者的特有的分子模式,由树突状细胞表面受体教授的。其中目前研究最仔细的是 Toll 样受体(Toll-like receptor, TLR)。例如TLR4对LPS的提呈敏感,而之前我们已经提到过的,LPS是革兰氏阴性菌的胞壁组分。除此以外,TLR4还可以识别一些病毒蛋白。TLR2同样也可识别某些特定的LPS,但该受体更擅长于识别那些作为革兰氏阴性菌“标记”的蛋白。
TLR3识别在大多数病毒感染过程中产生的双链RNA。而TLR9则识别细菌DNA所特有的非甲基化DNA二核苷酸——CpG。树突状细胞还具有可识别热休克蛋白的受体,而热休克蛋白是细胞在受刺激状态下或死亡时所释放的蛋白,通常认为,通过识别这些热休克蛋白的提呈,树突状细胞可以对细胞发出警示,告知与它们的相邻细胞已被病毒杀死。
虽然可以肯定会有越来越多的这一型受体将被发现,但目前的发现表明,树突状细胞(和巨噬细胞)的表面散布有各种受体,可供识别普通微生物入侵者的各种结构特征。某些入侵者可以触发不同的受体,所以这一识别体系是交迭冗余的,尽管稍微有些投机成分在内,但树突状细胞站在机体的不同部位守望,以不同的形式组合表达这些模式受体。
由于在感染发生时不同的病原体诱生不同的细胞因子,故树突状细胞可通过不同的细胞因子环境了解入侵者。此外,身体的不同部位(如皮肤和黏膜)在抵抗入侵者时,也会产生不同的细胞因子混合物,这有助于树突状细胞分清是机体的哪一部位遭受了侵袭。因此,在完善作战计划时树突状细胞“倾听”的第二类型的输入是通过表面受体对不同细胞因子应答而收集的。
所以,处于作战前线的树突状细胞通过模式识别受体和细胞因子受体接收关于入侵者的输入信息。随后,树突状细胞对这些输入信息进行解码,从而决定需要拿起何种武器并在哪里进行发射。丢失,这一由树突状细胞拟定的作战计划是如何传递至指挥战役的TH细胞呢?虽然关于这个问题还有一些细节没能弄清楚,但同样地,我们可以基本勾勒出一幅图片。尽管B7是目前研究得最清楚的、由激活的树突状细胞所表达的共刺激分子,但已有其他一些共刺激分子被发现,并且还会有越来越多的共刺激分子逐步为人们所发现。除了B7这样的表面分子外,由激活的树突状细胞分泌的细胞因子也具有共刺激活性。基本上,当一个激活的树突状细胞到达淋巴结时,它就会表达很多不同的共刺激分子。树突状细胞从战场接收到的“侦查报告”决定了由树突状细胞“提供”给淋巴结里原初TH细胞收集的共刺激分子,就是这种对共刺激信号的收集决定了将“作战计划”传递至原初辅助T细胞。
简而言之,树突状细胞位于机体所有暴露的表面之下,在那里它们静候代表了可能突破机体防御屏障的各种入侵者信息。这类信息由位于树突状细胞表面的受体收集,这些受体即识别代表不同这类入侵者特性的分子模式,也识别由其他细胞针对不同侵袭而分泌的细胞因子。然后,树突状细胞将所有这些信息进行整合,并携带迁移至临近的淋巴结,通过表达一些特定的共刺激分子组合,将“作战计划”传递给辅助T细胞,并“告知”它们需要何种武器以及将这些武器转递至何处。
需要强调的是树突状细胞是先天性免疫系统的成员。因此,先天免疫先天不仅仅是提醒获得性免疫系统何时有危险,同样也指导获得性免疫系统将合适的武器发送至需要的地方。
5.1.8 激活后辅助T 细胞的生命周期
一旦树突状细胞激活了原初辅助T细胞,后者在几天内即快速增殖,这一激活的TH细胞克隆成员随后被淋巴结中其他的树突状细胞重新激活并进行增殖。当然,如果所有的TH细胞被激活并增殖,产生的TH细胞会毫无用处。因此,最终(通常在一周之内)当TH细胞增殖至足够多,就会成熟为被免疫学家称作“效应器”的细胞,这些细胞可以实实在在做一些事情。下面将对此进行详细的讨论。
效应器辅助T细胞有两个主要职责。首先,它们存在于血液和淋巴循环中,并可在淋巴结之间迁移,为B细胞和 CTL提供帮助。其次,在发生“战场”的部位离开血管,为先天免疫系统和获得性免疫系统的“士兵们”提供帮助。效应器Th细胞分泌的初始细胞因子类别主要由它们在激活阶段接收到的共刺激决定的。例如,根据共刺激,辅助T细胞可以决定分泌Th1 或Th2型细胞因子。而其他的辅助T细胞(Th0)可能表现为无偏向性,可以产生更多种类的细胞因子。
一旦效应器抵达战场,它们分泌特定细胞因子的能力就会被改变或得以巩固。例如,在前线,应对细菌或病毒侵袭而活化的巨噬细胞会分泌 IL-12,IL-12可作为主要的细胞因子来影响TH细胞分泌Th1型细胞因子,所以当新近被激活的TH细胞离开富含IL-12的血液环境时,为定型(Th0)的辅助细胞就可以意识到战场上进行的是何种战斗,并被影响而分泌那些抵御细菌或病毒侵袭所必需的 Th1细胞因子(IFN-γ、IL-2、TNF)。此外,战场位点高浓度的 IL-12 可以巩固定型那些已决定分泌Th1细胞因子的辅助细胞。
相反,如果TH细胞在有寄生虫侵袭的位点离开血液时,它们就会发现召集处于富含IL-4的环境中。IL-4可以促使为定型辅助T细胞分泌Th2细胞因子(如IL-4,IL-5 和 IL-10),这些细胞因子对于帮助抵抗寄生虫侵袭非常有效。此外,高浓度的IL-4可以巩固已定型为分泌Th2细胞因子的TH细胞,使它们继续朝这一方向分化。
定型的TH细胞同样也可影响其临近的其他TH细胞分泌的细胞因子型别。
从这个意义上讲,辅助T细胞就像“福音传道者”,它们总是想让其他TH型别“皈依”它们的“信仰”。例如,Th1细胞分泌的IFN-γ与危险信号如细菌信号LPS一起,可以辅助激活巨噬细胞。随后被激活的巨噬细胞分泌 IL-12,后者可以影响未定型(Th0)辅助T细胞分化为Th1细胞。
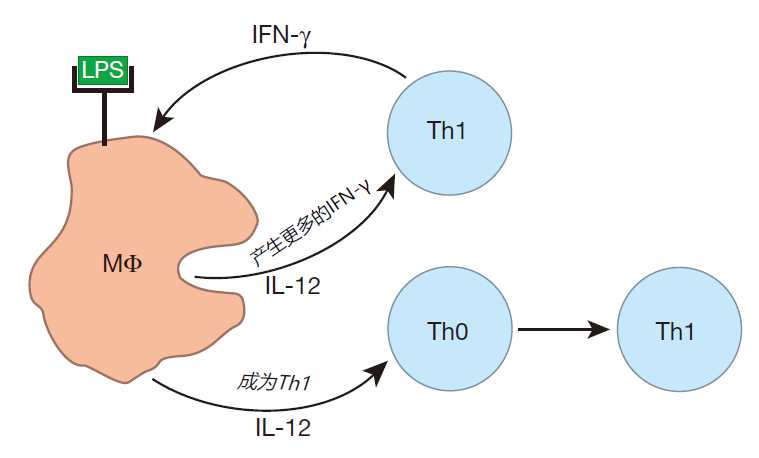
Th2细胞同样也是“福音传道者”,它们分泌的IL-4可以影响Th0细胞分泌Th2型细胞因子。因此,就这种情况而言,由定型TH细胞分泌的细胞因子直接或间接地募集其他卫定型的TH细胞分泌同样型别的细胞因子。
一旦TH细胞做出了选择,它就开始分泌其自身的生长因子:Th1 细胞分泌IL-2,后者为驱使Th1细胞增殖的生长因子;Th2细胞分泌它们偏爱的、可促使它们自身增殖的生长因子 IL-4。所以,每一亚型细胞分泌的细胞因子不仅仅可以促使新的TH细胞跟进分化,它们同样也会引起其分泌细胞增生,从而建立它们的数量群。
最后,在这一过程中,同样也存在着负反馈。Th1细胞分泌的IFN-γ可以降低Th2细胞的增殖速率,这样,只会产生更少的Th2细胞。
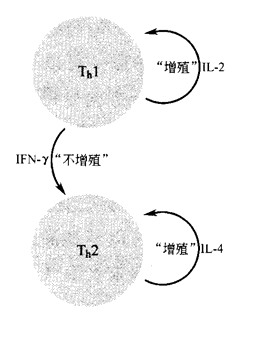
另一方面,作为Th2细胞因子的一种,IL-10也会抑制Th1细胞的增殖速率。
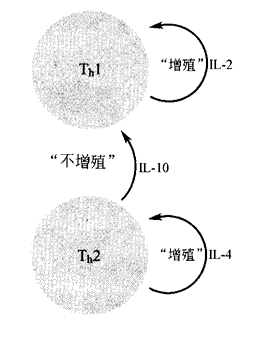
这里的底线是,一种TH细胞因子型别一经确定,那么正反馈和负反馈就会趋向于“锁定”这种特殊的型别。这种起始于定型和非定型辅助T细胞混合的精妙机制,随后强烈偏向于产生特定亚型的细胞因子,从而使系统有足够的灵活性来局部应对种类繁多的、同时或分别侵入的微生物。一旦TH细胞抵达战场,通过确保那里绝大多数的辅助T细胞为同一型别,正反馈和负反馈机制同时作用于针对临近入侵者的局部免疫反应。
5.1.9 延迟型超敏反应
有一个令人感兴趣的关于TH型别“信号征集”的例子。术语称为“延迟型超敏反应(DTH)”,这个现象是 19世纪后期Robert Koch在研究结核病复发时首次观察到的。Koch从引起结核病的细菌中纯化出结核菌素这一蛋白,并应用这一蛋白发明了著名的“结核菌素皮试”方法。如果做过这一皮试,你应该会记得护士会在你的皮下注射一些东西,然后告诉你在几天内观察那块区域,如果注射部位发红肿胀,你就得回医院进行检查。这里将详细介绍有关这个试验的全部。你所注射的东西是Koch的结核菌素蛋白,当你皮肤下的树突状细胞(称为朗罕氏细胞)摄入了结核菌素,它们就将之降解为片段,并利用MHCⅡ类分子提呈这些蛋白片段。组织中的树突状细胞表达足够的MHC和B7分子来重新刺激记忆细胞(有经验的)T 细胞,但却没有足够这些分子激活原初T细胞。如果你感染了结核杆菌或曾经感染过结核杆菌,你的免疫系统就会有记忆性的Th1细胞,这些细胞可以识别由皮下树突状细胞提呈的结核菌素片段,从而被再次激活。现在游戏开始了,这些TH细胞开始分泌IFN-γ和 TNF,这些Th1型细胞因子激活了临近注射位点的组织巨噬细胞,从而显著募集中性粒细胞和其他巨噬细胞至该区域,结果导致了以发红肿胀为表现形式的局部炎症反应,这样,你的结核杆菌检测就是阳性的。当然,你需要观察几天才能得到结果的原因是记忆辅助T 细胞需要被再次激活、增殖并产生这些绝对重要的细胞因子,从而引发炎症反应。
另一方面,如果你从来没有接触过结核杆菌,你就不会有记忆性辅助T细胞被再次激活,没有这些活化的TH细胞提供细胞因子,就不会有针对结核菌素蛋白的炎症反应,这样你的皮肤测试就是阴性的。
有趣的是,延迟型超敏反应既是特异性的,也是非特异性的。特异性是指Th细胞识别由树突状细胞提呈的结核菌素肽段,从而引发免疫反应。反应的非特异性部分则包括了由TH细胞分泌的细胞因子募集并激活的嗜中性粒细胞和巨噬细胞。这也是获得性免疫系统和先天免疫系统协调合作的又一个例子。
现在,你可能又会奇怪为什么用于这个试验的结核菌素不会活化原初T细胞,这样,当你下次检测时,你又会得到一个阴性的结果。原因在于结核菌素蛋白自身不会引起炎症反应,而且你应该还记得,如果战争开始了,树突状细胞也只会运载抗原至淋巴结。所以,如果你皮下注射了某种蛋白,而又没有引起炎症(也就是说,被你的先天免疫系统忽视了),那么树突状细胞就不会迁移至淋巴结,从而激活获得性免疫系统。这再次说明了先天免疫系统对于起始免疫应答是多么的重要:如果你的先天免疫不能识别危险的侵入者,并投入战斗,你的获得性免疫系统通常就会忽视侵袭。
5.1.10 CTL 如何被激活
前面,我们已经着重讨论了辅助T细胞是如何被激活以及它们的职责是什么,接下来我们需要关注CTL了,因为它们在淋巴结中的激活方式不同于Th细胞的激活方式,而且,当然了,一旦CTL被激活,它们行使的功能也完全不同于TH细胞。
尽管目前已经弄清楚了辅助T细胞是如何被激活的,但对于CTL的激活仍还有不明了的地方。问题之一是,在大多数情况下,原初CTL的激活不仅仅需要识别树突状细胞MHCⅠ类分子通常的其同源抗原,更需要辅助T细胞的帮助。
解决这一问题的方法之一是使树突状细胞、Th细胞和CTL共同形成“一夫二妻制”,然而,就像现实生活中很难见到的“一夫二妻”一样,辅助T细胞和CTL同时遇见一个提呈它们同源抗原的树突状细胞的概率是非常小的。
最近,更有一个假说支持了三种细胞相互作用的不可能性。该假说认为,树突状细胞是依次激活辅助T细胞和CTL的,在一支激活TH细胞的“舞蹈”中,树突状细胞设法获得随后激活CTL的“许可证”,这类CTL随后具备了能够识别由树突状细胞提呈的同源抗原的可能。
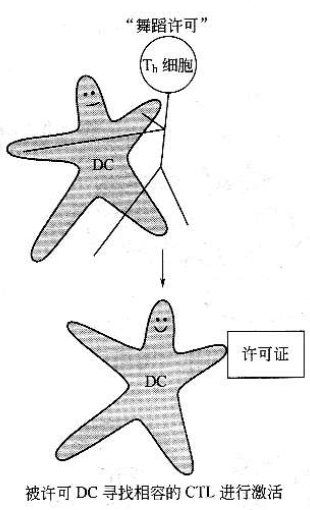
到目前为止,关于上述许可的机制还不太清楚。如前所述,Th细胞和树突状细胞之间的“舞蹈”可以升高树突状细胞表面的 MHCⅠ类分子和共刺激分子的表达水平,从而促使树突状细胞分泌细胞因子。所以,有可能是因为树突状细胞与许多激活的原初CTL所必需的“好东西”一起离开了舞池——但这仅仅是猜测。
5.1.11 CTL 被激活以后的生命周期
一旦CTL被激活后,它就会快速增殖,以建立自己的数量群。然后,它离开淋巴结,进入血液,搜寻机体内那些入侵者侵入、需要它去杀灭它们的部位。
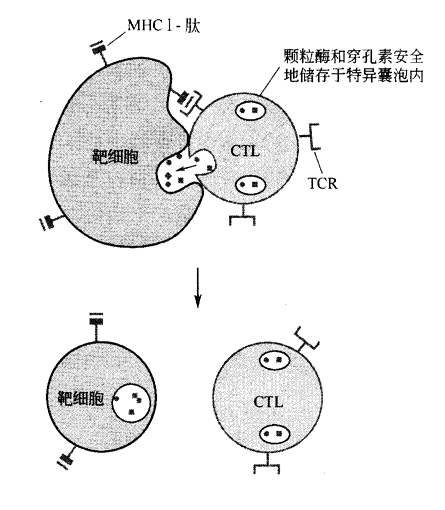
当它找到了这样的地方,它就离开血液,在被感染细胞上开始工作。CTL 的有效杀伤需要CTL核靶细胞相接触,在这场“肉搏战”中,CTL 能运用的武器不止一种。其中之一是分泌穿孔素蛋白。穿孔素与组成膜复合物一部分的C9补体蛋白有很近的亲缘关系,它可以结合在细胞膜并在其上穿孔。最新研究认为,当CTL运用穿孔素进行杀伤时,它的TCR必须首先识别靶目标,然后,由CTL上的黏附分子将靶细胞紧紧连在一起,同时,杀伤性细胞将穿孔素和颗粒酶B的混合物运至靶细胞表面,靶细胞随后将颗粒酶B和穿孔素包裹进入由靶细胞膜形成的囊泡中,从而摄入它们。
一旦进入靶细胞,穿孔素分子就在囊膜上凿孔,从而释放颗粒酶B入细胞质,在细胞质中,颗粒酶B起始酶链反应,使得细胞以凋亡方式自杀,这种促使自杀通常包括了靶细胞的DNA被其自身的酶毁坏。
CTL还通过一种位于CTL表面的蛋白——Fas 配体(FasL)行使其杀伤作用。当FasL与靶细胞表面的 Fas 蛋白结合,就可启动靶细胞的自杀程序,进而,靶细胞通过凋亡而死亡。
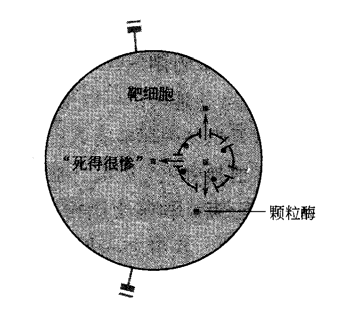
实际上,细胞死亡是有两种截然不同的方式——坏死或凋亡。尽管最终所导致的结果是一样的,但细胞通过坏死或凋亡而死亡的过程中发生的事件却是完全不同的。当机体有伤口(如切口或烧伤),或者因病毒或细菌的侵袭而导致细胞的毁灭时,细胞即通过坏死而死亡。当坏死发生时,正常情况下活细胞中所包含的酶和化学物质就释放入周围组织中,形成对组织的损伤。相反,以凋亡的形式进行的细胞死亡就干净的多了,当细胞以凋亡的形式死亡时,它的内容物被包裹入由将死细胞的细胞壁所形成的囊泡中,这些小泡随后被临近的巨噬细胞所吞噬并摧毁,这也是巨噬细胞清道夫职责之一。这样,在凋亡过程中,靶细胞的内容物就不会溢入组织而形成组织损伤。所以,通过选择凋亡而不是坏死来杀伤它们的靶细胞,CTL可以除去机体中受病毒感染的细胞,而不是间接引起由于坏死细胞的死亡而导致的组织损伤。
还有另外一个理由可以用来解释为什么对于杀伤性T细胞在消灭受病毒感染的细胞时,通过凋亡引发细胞的死亡是一个特别有效的方法。当病毒感染的细胞通过凋亡而死亡时,未装配的病毒DNA可以和靶细胞的DNA一起被摧毁。
此外,在受感染靶细胞中已经组装的病毒可以一起被包裹入凋亡小泡内,从而被巨噬细胞一起吞噬处理掉。正是这种通过诱导凋亡而消灭被感染细胞的能力,使得杀伤性T细胞成为如此有效的抗病毒武器。
尽管单独的一个CTL就可以依次消灭许多靶细胞,但在一次侵袭时可能有上千个细胞感染。所以为了放大杀伤能力,CTL一旦抵达战场就进行增殖。大多数的CTL通过从外部补给 IL-2而促成其自身的增殖——Th1 细胞是这种细胞因子的主要提供者。因此,当需要许多 CTL(如在病毒感染过程中)时,分泌Th1 型细胞因子的辅助T细胞能为杀伤性T细胞增殖提供 IL-2。通过这种方法,辅助T细胞“召集运动员”并对杀伤性T细胞的反应强度进行调控。
5.1.12 记忆T细胞
大多数T细胞在被激活并完成自己的使命后,就通过凋亡而进入程序化死亡,免疫学家称之为激活诱导的细胞死亡(ACID)。这一点非常有意义,因为机体不需要免疫系统四处遍布已被激活只能抗击“已故”侵袭者的辅助T细胞和杀伤性T细胞。当下一次有新的微生物试图攻击机体时,ACID就可以腾出空间,来容纳针对这些微生物反应而需要被激活的新的T细胞。
另一方面,体内也有一些老队员存在,防止同样入侵者的再次侵袭。幸运的是,每次我们遇袭时,免疫系统都留下一些激活的T细胞作为“记忆细胞”。这些细胞处于极其兴奋的状态,使得激活信号可以非常有效地从细胞膜传递入核。因此,一旦它们的TCR被它们所识别的入侵者再次动员,它们就可以很快地投入战斗保护机体。
迄今为止,关于激活的T细胞是如何被选取作为记忆细胞,还有很多未知的东西。有些免疫学家认为记忆T细胞是那些在第一次侵袭中仅被部分活化的细胞,而其他免疫学家可能更倾向于认为记忆T细胞是从完全激活的T细胞库中选取出来的(然而它们还不清楚是如何选出来的)。同样,目前也不完全清楚这些“幸存者”成为记忆细胞后,又是怎样存活的?现在有这样一个观点认为,在应对细胞因子的反应中,即使记忆T细胞的同源抗原已被机体清除,它们仍能缓慢增殖以保持自身数量群。所以,即使已明确记忆T细胞可为未来的侵袭提供长期的保护作用,但对于这些记忆T细胞是如何被选择并存活下来,还有许多未知的东西等待我们去发现。
5.2 结语
在本章结束之前,你应该已熟悉了先天免疫系统和获得性免疫系统所有的主要成员,你应该了解,这些成员相互形成网络,在那里它们一起工作,为我们抵抗疾病,然而,为使这个网络保持运作,必须小心指导各个成员的运动,以增强它们之间的协作,确保将合适的武器运送到机体需要的部位。关于这些过程是如何运作的内容我们将在下一章进行讨论。
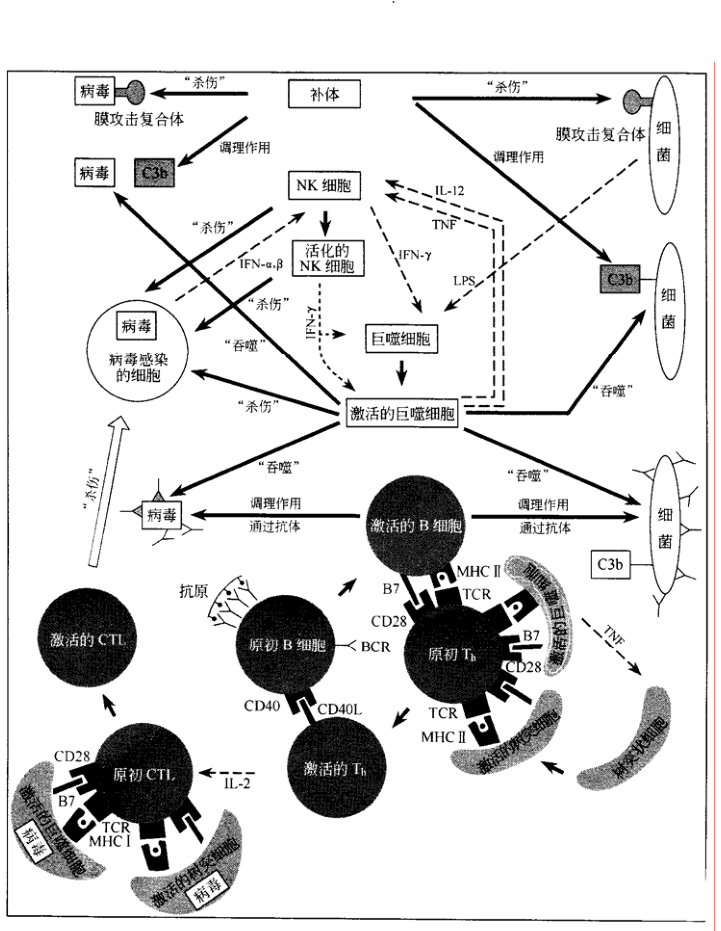
5.3 总结图
最后是一张小结图,显示了先天性免疫系统和获得性免疫系统,以及它们形成的网络,你可以认出所有的成员吗?你了解它们之间是如何相互作用的吗?