7 耐受诱导和MHC限制性
7.1自身耐受与MHC限制性
本讲的主题是免疫学中最令人兴奋的主题之一。尽管已针对免疫耐受性和MHC 限制性做了大量的研究工作,但其机体的机制仍悬而未决,然而它却是确实如此的重要!B 细胞和 T 细胞必须学会不要把我们的自身抗原识别为危险信号,否则我们将死于自身免疫病。此外,T 细胞必须限制性识别自身的MHC分子,这样 T 细胞就会将注意力集中于 MHC-肽复合物,而不是那些未被提呈的抗原。实际上,如果有一位免疫学家最终发现 T 细胞如何学会上述重要的两课,他毫无疑问将获得诺贝尔奖。
在了解免疫耐受和 MHC 限制性的过程中,最主要的问题也许在技术上很难再现 T 细胞是如何受教的。通常你会选择将一个自身抗原模型导入动物体内(如小鼠),并观察这种抗原受体的 T 细胞是怎样产生耐受或受到限制的。然而由于T 细胞受体的种类繁多,所以在小鼠体内只有很少一部分的 T 细胞会带有能识别特定抗原的受体。因此要在众多不能识别指定抗原的 T 细胞中搜寻到这些稀少的 T 细胞真是很困难的。
为了增加能与给定抗原作用的 T 细胞的数目,可以采用两种方法,但这两种方法都有缺陷。第一种方法是使用超抗原,所谓超抗原就是能在小鼠体内引起相对高比例(一般 5~20%)的辅助 T 细胞激活的蛋白。超抗原的来源有两种——细菌产生的毒素和病毒编码的蛋白。这两类超抗原都可以与 TCR 可变区及MHCⅡ类分子结合,从而将上述两者连锁在一起。
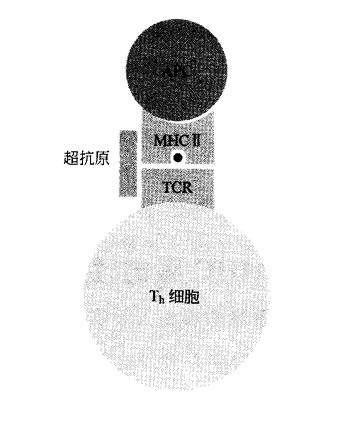
超抗原的这种连锁作用使得 MHC 和 TCR 之间的结合十分牢靠,以至于基本上每一个拥有此类特殊可变区的 T 细胞都会被激活。也许你会想,一旦使体内 25%的 Th 细胞激活,可能会带来一些问题。实际上,由金黄色葡萄球菌这种常见细菌所编码的超抗原,会引起免疫系统过度激活,从而造成中毒性休克综合症和食物中毒等症状。尽管超抗原在几年前曾风靡一时,但因为免疫学家发现 T细胞受体与超抗原间相互作用的方式迥异于我们在前面所讨论的 TCR 与 MHC-肽之间的常规相互作用,这种方法现在已经不常使用了。
免疫学家由于研究 T 细胞的第二类工具是使用只产生单一 TCR 的小鼠。转基因小鼠技术已经发展到可以随意剔除任一个基因,并用另一个基因进行替代。
所需要的只是大量的小鼠和大量的经费。不管怎样,免疫学家将一个可以识别由小鼠 MHCⅠ类或Ⅱ类分子所剔除的某种经预先组合(pre-assembled)的特殊蛋白(如来自鸡的蛋白)的 TCR 基因插入到小鼠的染色体中去,然后让这种转基因小鼠与不能装配其自身 TCR 基因的突变小鼠交配,结果,后代小鼠就只产生能识别鸡蛋白 TCR 的 T 细胞。这并不是这种小鼠所有的优势,但它确实可以使人们模仿 T 细胞识别过程这一工作变得更容易。然而,正如你将在本章中所看到的一样,在 T 细胞成熟和识别的过程中,其表面表达的 TCR 数目会随时间而变化。而这些转基因鼠体内的 TCR 则不会如此变化,它们只在发育的一个特殊阶段以一定的水平表达,所以,解释用这些小鼠进行的试验时,你必须考虑得到的结果是否受到了 TCR 表达时间及水平的影响。
7.1.1 胸腺
T 细胞最早是在位于颈下的一个小器官——胸腺内形成自身耐受的。这一过程通常被称为“中枢耐受的诱导”。下图是免疫学家眼中的胸腺。
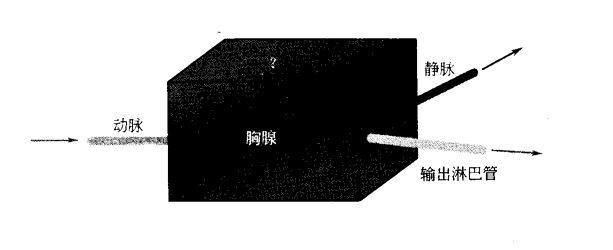
如你所见,胸腺是一个神奇的器官,它和脾脏一样,没有输入淋巴管,所以细胞是随着血液进入胸腺的。然而,与脾脏相反,胸腺并不欢迎血液中的任何成分进去,进入胸腺的细胞有严格的限制性,尽管免疫学家还不知道通行“口令”是什么。来自骨髓的未成熟 T 细胞会通过血液从胸腺中央某处进入胸腺。然而这一过程究竟是怎样发生的还不清楚,因为胸腺种没有可供血液中的淋巴细胞进入二级淋巴器官的高内皮细胞,抗原也可以从血液进入胸腺,但引导其进入的机制也尚不清楚。
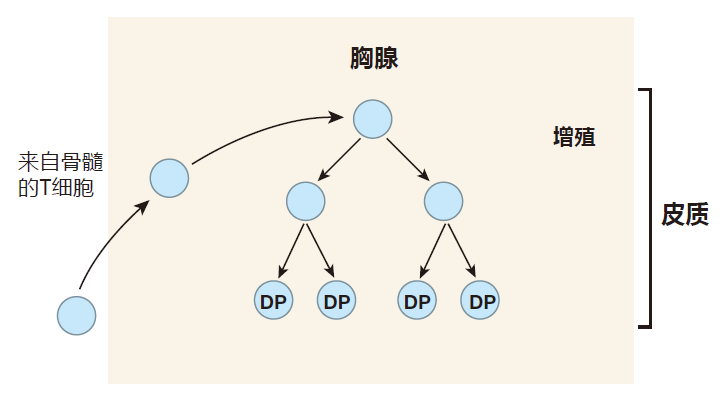
我们目前所知道仅是从骨髓进入胸腺的 T 细胞是“全裸”的——它不表达CD4、CD8 或 TCR。这些细胞首先进入胸腺外围区域(皮质)并且开始增殖。

此时,其中的一些细胞开始对编码 TCRα链和β链的基因片段进行重排,如果重排成功,T 细胞便开始低水平表达 TCR 及其相关辅助蛋白(CD3 蛋白复合物),结果,这些起初“全裸”的 T 细胞表面很快在其表面穿上了由CD4、CD8和TCR分子组成的外衣,因为所有这些 T 细胞都表达 CD4 和 CD8 共受体分子,所以它们被称为“双阳性(DP)细胞”。
在这穿衣过程中,会发生另一个重要变化。T 细胞“全裸”时,可以避免因凋亡而死,因为它不表达 Fas 抗原而高水平表达 Bcl-2。相反,双阳性 T 细胞表面表达高水平的 Fas,而只产生很少量的 Bcl-2,所以,它对启动凋亡的信号很敏感,处在这种极其脆弱的状态下时,T 细胞将受到自身耐受和 MHC 限制性检验,如果不能通过其中的任何一项检验,T 细胞就会被杀死。
7.1.2 MHC 限制性
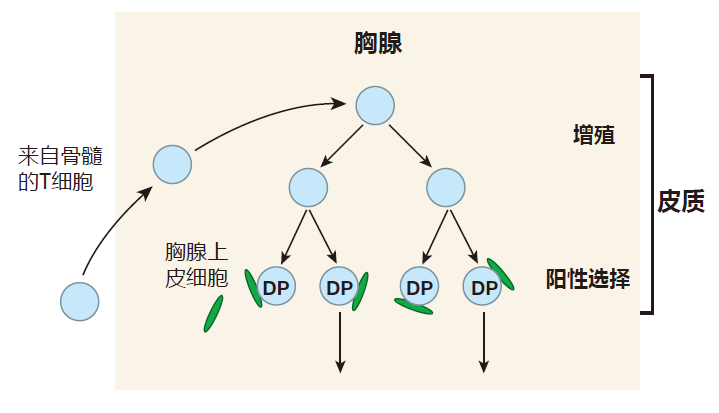
免疫学家仍不能确定这两项检验是以何种顺序进行的,所以为了便于讨论,假定 MHC 限制性检验先于自身耐受性检验。检验 T 细胞 MHC 限制性的过程通常被称为“阳性选择”,这里的检验者是胸腺皮质区的上皮细胞,它向 T 细胞提出的问题是:“你认识表达于我表面的自身 MHC 分子中的任何一个吗?”正确的答案是:“是的,我认识。”因为如果 TCR 不能识别任何自身的 MHC 分子,T 细胞就会死亡。
我所说的“自身”MHC,仅仅是指那些由拥有此胸腺的人(或小鼠)所表达的MHC 分子,这听起来似乎显得多余——我的 T 细胞当然要在我的胸腺中被我的MHC 分子所检验,但免疫学家喜欢用“自身 MHC”来强调这一点。
皮质上皮细胞表面的 MHC 分子实际上与特定肽段结合,因此 TCR 真正识别的是一个自身 MHC 分子与其相关肽的结合体,这些肽为胸腺细胞产生的蛋白质样本(MHCⅠ类分子展示)加上胸腺细胞从胸腺组织中拾取的蛋白质样本(由MHCⅡ分子展示)。
7.1.3 MHC 限制性的合理性
在进行另一个检验之前,先来考虑一个重要的问题:为什么T细胞需要经受检验以确定它们能够识别由自身MHC分子提呈的肽段?毕竟,大多数人的一生中都不会出现“外源”MHC 分子(如在一个移植器官上的),所以限制性不必涉及区别你和我的 MHC分子。的确,MHC限制性与区分外源的还是自身的无关,它完全是一个确定“焦点”的问题。正如我们在第 4 讲中所讨论的,我们需要建立这样一个系统以使T细胞将焦点集中在由MHC提呈的抗原上。然而,T细胞受体是通过基因片段的混合与匹配所形成的,它们具有广泛的多样性,结果,就像B细胞受体一样,在T细胞表达的TCR集合中,必然很有许多TCR能识别不被提呈的抗原,这些T细胞必须被清除掉,否则,通过MHC分子提呈抗原的系统将不会运转。所以,阳性选择(MHC 限制性)如此重要的原因就在于它建立了一个系统,在这一系统中所有成熟的T细胞都带有能识别由MHC分子提呈抗原的TCR。
7.1.4 中枢耐受的诱导
拥有能识别自身MHC与抗原肽复合物TCR幸运T细胞在胸腺中进入第二轮检验——自身耐受。这种检验常被称为“阴性选择”。主持这一检验的细胞与主持阳性选择的细胞是不同的。主持阳性选择的细胞是真正的胸腺细胞,它们从胚胎发育时起就存在于胸腺中,而主持阴性选择的细胞是树突状细胞,它们是从骨髓迁移到胸腺中来的。尽管胸腺DC拥有典型DC的海星状外形,但它们不同于抗原提呈DC或我们前面所提到的FDC。胸腺DC主要集中于胸腺中央区被称为髓质的地方。
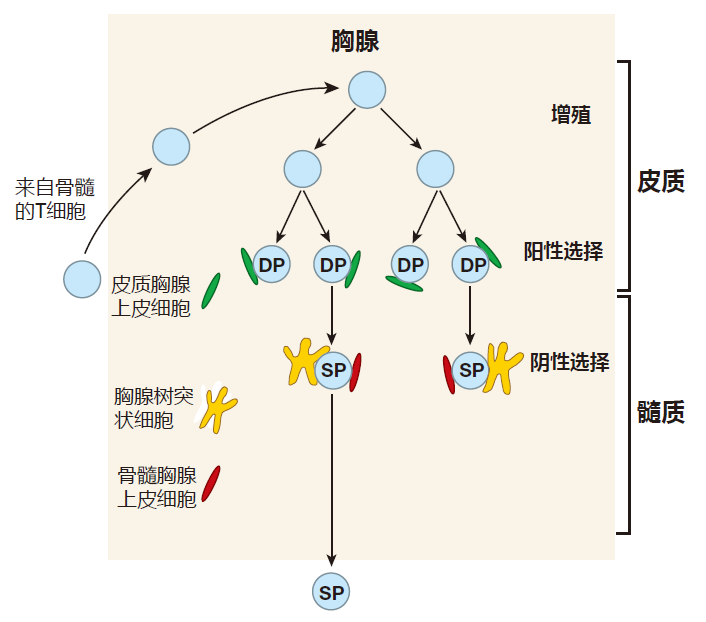
胸腺DC提出的检验问题是:“你认识表达于我表面MHC分子所提呈的任何一种自身抗原肽吗?”正确的答案是:“不。”而带有能识别MHC分子和自身抗原肽复合物受体的T细胞将被杀死。这第二个检验会清除那些可能对自身抗原作出相应应答的T细胞,这个检验之所以如此重要的原因就在于如果这些自身反应性T细胞不被清除,将引发自身免疫病。例如,识别自身抗原的Th细胞能协助B细胞产生以自身分子(如血液中的胰岛素蛋白分子)为目标的抗体。此外也会产生CTL攻击自身的细胞。
阴性选择的重要特征之一就是主持这一检验的细胞——胸腺DC在胸腺中仅存活几天。因而它们只能提呈“当前的”自身抗原。这的确是一个聪明的做法,因为有外来抗原进入胸腺(通常发生于感染状态时),DC可以捕获这些抗原并利用它们来进行检验,就好比它们是“自身”抗原一样。因而只要胸腺 DC 总在提呈外来抗原,那么任何能识别入侵者的正在成熟的T细胞都将被清除掉。胸腺 DC的短暂寿命使这种可能性得以避免,并使得T细胞仅被用“新物质”检验。一旦与感染有关的外来抗原从机体彻底清除了,新产生的DC就不再像提呈自身抗原一样提呈外来抗原,这样,能识别入侵者的 T 细胞就能顺利通过阴性选择而存活下来。
所有这些检验的最终结果是,存活下来的T细胞表达能识别由胸腺上皮细胞提呈的自身MHC-肽复合物的受体,但该受体不识别由胸腺DC上 MHC 分子提呈的自身抗原。通常大多数学生都不会对出现1小时以上的考试感到兴奋,所以我想你也有兴趣知道,上述两项检验一共耗费两周的时间!这里我们所说的是每个T细胞的生命都悬于摇摆不定的天平上的检验。
通过这些检验的“胸腺毕业生”表面高水平地表达T细胞受体以及CD4 或CD8共受体,但并不同时表达 CD4或CD8。因而,它们被称为“单阳性(SP)细胞”。在一个年轻人的胸腺中,每天大约有 6000 万个双阳性细胞经历着上述检验,但最终只有约200万个单阳性 可以离开胸腺,亦即只有 3%的“候选人”能通过这些检验,余下的凋亡死去,并很快被胸腺内的巨噬细胞吞噬。
7.1.5 MHC 耐受性和耐受诱导之谜
如果你认真阅读过上文,现在也许就会想知道一个T细胞怎样才有可能通过双重检验。毕竟,要想通过MHC 限制性检验,T细胞的TCR就必须要能识别带有自身肽的MHC,然而,要想通过耐受性检验,它们的TCR又必须不能识别带有自身肽的MHC。看起来,难道这两种检验不是会彼此抵触,不允许任何T细胞通过吗?的确是,这正是自身耐受之谜的实质——同一个TCR怎么同时介导阳性选择(MHC限制性)和阴性选择(耐受诱导)?实际情况也许比这还复杂,因为一旦T细胞在胸腺中激活后,当它们遇到由MHC分子提呈的入侵者后,其TCR必须能传递激活信号。这样一个问题一直困扰着免疫学家:同一个TCR在识别MHC-肽复合物时,如何能发出信号诱导产生阳性选择、阴性选择或激活这三种完全不同的结果。
遗憾的是,我无法回答这个迷题(否则,我就能拿诺贝尔奖了),但是我可以告诉你当前流行的见解。免疫学家相信,导致产生MHC限制性和耐受诱导的事件与那些导致T细胞激活的事件是相似的,包括了细胞-细胞间的黏附,TCR的簇集以及共刺激。假设在胸腺中,由TCR和胸腺上皮细胞所提呈的MHC-自身肽之间相对较弱的相互作用导致了具有可识别自身MHC受体的T细胞的阳性选择(存活)。阴性选择(死亡)则是由 TCR 与起源于骨髓的胸腺 DC 所提呈的MHC-自身肽之间的强相互作用所诱发的。离开胸腺后T细胞的活化是由 TCR与由专职APC提呈的 MHC-肽之间强相互作用所诱导的。
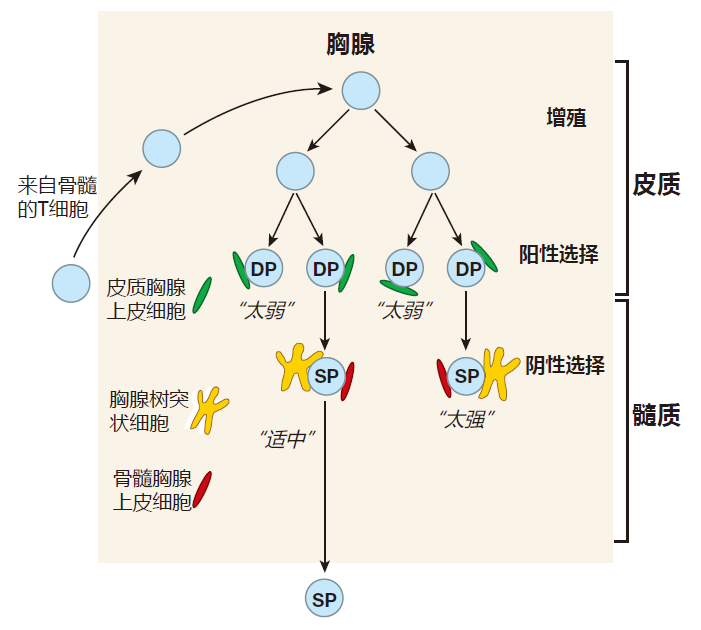
当然,问题就在于是什么使得 MHC-肽与 T 细胞受体间的三种相互作用所产生的结果如此之大——存活、死亡或激活。一个关键的因素就是传递信号的细胞特性不同。与 MHC 限制性相关的是胸腺上皮细胞,与耐受诱导相关的是骨髓源性DC,与激活相关的是特殊的 APC。这些细胞不同,因而它们表达的细胞黏附分子也不同,其表面所提呈的 MHC-肽复合物数目也不一样。这些差异能显著地影响通过 TCR 传递的信号强度。此外,这 3 种细胞类型可能表达不同的共刺激分子混合物,而共刺激信号可以改变由 TCR-MHC-肽集合所产生的信号含意。
不仅传递信号的细胞有差别,信号接受者(T 细胞)在不同的检验期也会发生变化。现在已经知道,T 细胞表面 TCR 的数目在细胞活化时会增加,也可能在T细胞成熟时其内的信号通路发生了改变。这些TCR丰度和信号处理上的差异能够影响对三种类型的传递细胞所传递信号的解释。
尽管目前已经解开了给与MHC限制性/耐受诱导谜团种的部分,但免疫学家仍然不能把它们这成一个完整的故事,然而,很可能这个重要的迷题很快就会被解开。
7.1.6 由漠视引起的耐受
值得欣慰的是,大多数带有能识别自身蛋白受体的 T 细胞在胸腺中被清除了,然而正是耐受并不是绝对可靠的。如果是的话,那么每个单独的 T 细胞将不得不在胸腺接受每个可能的自身抗原的检验,这种工作量是很大的。一般来说,带有对胸腺中大量存在的自身抗原具有高亲和力受体的 T 细胞极有可能在胸腺中被清除了,然而携带对自身抗原具有低亲和力受体或能识别胸腺中极罕见的自身抗原受体的 T 细胞被阴性选择筛选掉的可能性就小些,它们可能借助中枢耐受诱导的缝隙溜脱掉了。幸运的是,防范这种可能性发生的系统已经建立起来了。
原初 T 细胞在二级淋巴器官中循环,但并不被允许渗出到组织中去。这种运输模式可以将这些原初T细胞带往身体中它们最有可能遇到 APC 并被激活的地方去。然而,这种确保原初 T 细胞位于组织外的限制性运输在维持自身耐受方面也是很重要的。因为,通常那些大量存在于原初淋巴细胞被活化时所处的二级淋巴器官内的自身抗原同样也大量存在于 T 细胞建立耐受的地方——胸腺。所以由于原初 T 细胞所遵循的运输模式,导致大多数能被二级淋巴器官中富集自身抗原激活的 T 细胞在此之前就已经通过接触胸腺中大量相同的自身抗原而被清除掉了。
相反,携带识别胸腺中相对稀少的抗原受体的 T 细胞能逃脱被清除的命运。
然而,这些相同的抗原通常以较低浓度存在于二级淋巴器官中,那里的 APC 表面所结合的 MHC-肽复合物数量也少的不足以激活 T 细胞。因此,尽管在二级淋巴器官中存在有极少量的自身抗原,并且尽管 T 细胞具有能识别它们的受体,但因为抗原实在少得不足以引起 T 细胞激活,这些 T 细胞仍对它们的存在持“漠视”态度。所以淋巴细胞运输模式不论在确保获得性免疫系统的有效激活方面,还是在维持对自身抗原的耐受方面都起着关键性的作用。
7.1.7 外周耐受
当然,原初T细胞不是完美的,有些原初 T 细胞不遵守既定的运输模式,而是冒险渗出到了组织内。在那里,这些细胞也许会遇到那些在胸腺中少得不足以引起其缺失,而在组织中却多得足以引起其激活的自身抗原。例如,在心脏或肾脏内有大量的“器官特异性”自身抗原,但它们在胸腺中的浓度之低使得可以忽视它们的存在。为了应付这种情况,就产生了针对自身免疫病的第三级保护——外周耐受。
因为 T 细胞激活具有两个关键的要求,所以原初 T 细胞不仅必须接触到足够多的被提呈抗原使其表面受体簇集,而且必须从抗原提呈细胞那里接受到共刺激信号。这就是 APC 起的作用。这些特殊细胞表面有很多用于提呈抗原的MHC分子,同时它们也表达共刺激分子,如 B7。相反,“常规细胞”如心脏和肾的细胞一般不表达高水平的 MHC 蛋白或者不表达共刺激分子,甚至两种分子均不表达。结果,带有识别肾抗原受体的原初 T 细胞可能识别某个肾细胞,但并不激活。实际情况甚至还要好些。当一个 T 细胞识别到位于某个细胞的同源抗原,但并未接收到相当水平适当的共刺激信号,这个 T 细胞就是“中性”的。它看起来像是 T 细胞,但它不能继续行使自己的职能。免疫学家称这个细胞为“无反应性”。
在很多情况下,无反应性的细胞最终会死亡,所以外周耐受的诱导能导致细胞无反应性或死亡(清除)。因此,第二个关键要素——也就是在 T 细胞活化过程中的共刺激就能保护我们免受冒险脱离其正常运输模式的原初 T 细胞的威胁。
7.1.8 激活诱导的死亡所引起的耐受
现在让我们来看看,如果一个 T 细胞在胸腺中逃脱了被清除的命运,并且打破了其运输规则,冒险渗出到了组织中,情况将会是怎么样呢?如果这个T细胞恰巧发现了某个细胞表面MHC分子提呈的浓度足以引起其表面受体交联的同源抗原,而这个细胞又恰好可以通过T细胞活化所需的共刺激,情况又会是怎样呢?接下来又将会发生什么呢?不要担心,一切尽在掌握中,因为还有另一个耐受诱导的“保证者”可以在这种不大可能发生的情况下保护我们,这就是激活诱导的细胞死亡。来看看它是如何起作用的。
一旦消灭了入侵者,终止免疫应答的机制存在就显得尤为重要。例如,一旦消灭了入侵者,大多数T细胞将因机体内不再有残留的抗原刺激它们而死去。
这是清除残余T细胞的途径之一,但还有其他的途径可以在T细胞不再被需要的时候将其清除。
CTL 表面高表达 FasL,它们行使杀伤功能的途径之一是将这种配体蛋白插入其位于靶细胞表面的结合伴侣——Fas。一旦这两种蛋白相互结合,就会启动靶细胞通过凋亡而自杀的途径。原初 T 细胞对 Fas 蛋白的结合不敏感。然而当这些 T 细胞被激活并在攻击中多次再激活时,它们会变得使其自身 Fas 配体蛋白及其他 T 细胞上的 Fas 配体蛋白变得对 Fas 结合更为敏感。这就使得这些老化的T细胞成为了Fas介导的杀伤作用的靶细胞,不管是通过自杀还是他杀。
免疫学家把这种现象称为活化诱导的细胞死亡。通过活化诱导的细胞死亡清除老化T细胞的意义重大,毕竟,大多数病毒或细菌的入侵,都会导致急性感染,这种感染有可能被免疫系统快速清除(通常在数天或数周内),也有可能会打败免疫系统而置你于死地。所以缺失没有必要让激活的 T 细胞存活很长一段时间来对付急性感染。
除了提供各种机制以清除老化 T 细胞以外,激活诱导的细胞死亡也可帮助对付那些打破运输法则并被终止中的自身抗原激活的原初T细胞。这种情况下 T细胞总是被长期存在的自身抗原反复刺激,这样,这些自身再激活的T细胞通常就可通过激活诱导的细胞死亡而被清除。就像是免疫系统感觉到了这种不自然的再激活,从而杀死那些犯规者-即自身再激活的T细胞。
总之,T细胞耐受的诱导是多层次的。没有哪个单独的耐受诱导机制是百分之百有效的,但是正因为这种多要素机制的存在,使得发生自身免疫病的概率相对小了。那些携带能识别二级淋巴器官内大量存在抗原受体的 T细胞往往在胸腺中就被有效清除了。在胸腺中,自身抗原含量少得不足以使自身再激活的T细胞逃脱被清除的命运,它在二级淋巴器官中也往往少得不足以激活原初T细胞。因此,原初T细胞的限制性运输模式往往使得它们可以对胸腺中少量的自身抗原保持功能性的漠视。在这种情况下,如果原初T细胞冒险脱离血液-淋巴液-二级淋巴器官这一系统,它们往往会在一个能导致其无反应性或死亡,而且非激活的环境中接触到组织特异性抗原。最终,那些极少数通过识别组织中自身抗原而被激活的T细胞通常会因受到强烈的再刺激而死亡。
7.1.9 B细胞耐受
免疫学家一度认为,将带有识别自身抗原受体的 B 细胞清除掉可能不是必要的。因为那些能帮助潜在的自身再激活的 B 细胞所必需的 T 细胞已经被杀死或丧失作用了,B 细胞耐受将被 T 细胞耐受所掩盖。然而,当发现 B 细胞有时可以再没有 T 细胞辅助的情况下激活时,人们意识到必定有某种机制使 B 细胞产生耐受。尽管对 B 细胞耐受的研究并不如 T 细胞耐受清楚,但这两种耐受的诱发之间存在着很多的相似之处。
现在认为 B 细胞可以再它们的出生地——骨髓内产生耐受性。以下是 B 细胞相应的中枢耐受的诱导过程:当 B 细胞基因片段通过混合和匹配以构建出最终的受体基因之后,它们就会接受检验,看看这些受体能否识别骨髓中的自身抗原。如果其受体确实能识别自身抗原,该 B 细胞还有另一个就会急性轻链基因重排以改装出新的 不能识别自身抗原的受体,这一过程被称为“受体编辑”。尽管有关受体编辑过程中的细节问题还不甚明了,但似乎至少有 25%的 B 细胞利用了这个二次就会。最终,所带受体不能与至少抗原结合的 B 细胞离开骨髓,而其余的带有能识别自身抗原受体的 B 细胞则被杀死。
当然,在骨髓中诱导的 B 细胞耐受与胸腺内诱导的 T 细胞耐受具有同样的问题:带有能识别骨髓中微量自身抗原受体的 B 细胞能乘机溜走。幸运的是,骨髓中通常含有与原初 B 细胞激活时所处二级淋巴器官中同样多的自身抗原,结果,在骨髓内少得不足以有效清除 B 细胞的自身抗原往往在二级淋巴器官内也少得不足以激活 B 细胞。所以原初 B 细胞的运输漠视(限制它们流经二级淋巴器官)有助于保护它们避免遭遇到大量骨髓中没有的自身抗原。
也存在这某些机制能诱导那些不遵循这一运输法则的 B 细胞产生耐受。例如,冒险进入组织的原初 B 细胞如果识别到同源抗原却没有接受到 T 细胞辅助,就会无反应性或者被清除。此外,受到自身抗原不断刺激的 B 细胞最终会因凋亡而死。因此,B 细胞产生自身耐受的机制与胸腺外 T 细胞耐受相似,但又不完全一样。
7.1.10 生发中心内 B 细胞耐受的维持
你也许会想是否经历过体细胞超突变的 B 细胞就会带有能识别自身抗原的受体,如果是那样,那么这些 B 细胞就会产生能引起自身免疫病的抗体。幸运的是,这种情况通常不会发生,其原因是很令人感兴趣的。
生发中心的 B 细胞是非常脆弱的。除非接收到拯救信号,否则它们就会发生凋亡。从这个意义上说,生发中心的 B 细胞与那些在胸腺中经历过 MHC 限制性和耐受诱导选择的脆弱 T 细胞十分相似。要将生发中心内的 B 细胞从死亡中拯救出来所需的信号与那些首次激活 B 细胞时所需的信号是相同的——识别与BCR 交联的同源抗原以及来自 Th 细胞的共刺激信号。当处于生发中心内时,B细胞似乎或多或少都需要这两种拯救信号。
如果 B 细胞在生发中心发生超突变以使其受体识别自身抗原,它就极不可能发现 FDC 上提呈的自身抗原(或被其拯救)。毕竟,FDC 只提呈被调理过的抗原,而自身抗原通常没有被调理国。而且,有实验表明,生发中心内的 B 细胞要想逃脱死亡的命运,不仅其表面的 BCR 必须同抗原发生交联,而且其补体受体作为共受体也必须与调理抗原的补体片段相结合。这种针对 BCR 和补体受体交联的双重要求可能解释了为什么缺乏功能性补体系统的人不具有生发中心。
所以自身再激活的 B 细胞在生发中心内要面对的首要问题就是,FDC 上缺乏被补体调理过的自身抗原。接下来含有另一个问题——缺乏共刺激,这个问题产生的原因更令人感兴趣。Th 细胞在二级淋巴器官的 T 细胞区内被激活后,就迁往淋巴滤泡去辅助 B 细胞,这种辅助作用发生在 Th 细胞和 B 细胞相互刺激的时候。此时,Th 细胞提供对 B 细胞进行共刺激所需要的 CD40L。作为回应,激活的 B 细胞向辅助 T 细胞提供 B7 共刺激并利用其 MHCⅡ类分子向 Th 细胞通常其同源抗原片段。这一过程中的重要且微妙之处在于,为使 B 细胞与 T 细胞之间发生相互激活,这些细胞必须接触到相同的抗原。所以,如果 B 细胞发生超突变使其 BCR 能结合并提呈一个不同的抗原(如自身抗原),这个新抗原将不会是 Th 细胞的同源抗原。结果,B 细胞和 T 细胞之间就不能相互协作以维持相互刺激。它们将丧失共同的利益,它们之间也就不再相互作用了。
因为 B 细胞需要 T 细胞的辅助才能在生发中心存活,所以 B 细胞与 T 细胞的相互依赖就使得 B 细胞在经历体细胞超突变后仍能保持其原有的轨迹。所以,B 细胞在发生体细胞超突变期间维持自身耐受的原因有两个:一是缺乏产生有效的 BCR 信号所需的补体调理国的自身抗原;一是缺乏能辅助 B 细胞识别自身抗原的生发中心 Th 细胞。
7.2 总结图
T 细胞耐受是一个多层次的过程,其中几个耐受诱导机制的层次确保了大多数人不会发生自身免疫病。
7.3 结语
在本阶段,你们应该对健康的人体内免疫系统是怎样设计与发挥有了一个全面的认识,在接下来的两讲中,我们讲探究免疫系统在疾病中扮演的角色。


