4.6 端粒与细胞衰老
在本节中,我们将探讨细胞衰老与端粒之间的关系,端粒是每个染色体末端重复的非编码碱基对序列。我们解释了在每一轮细胞周期中端粒的丢失是如何触发导致永久性生长停滞(细胞衰老)的生化途径。我们讨论了时间依赖性病理学(如癌症)的发展如何反映了一种高度保守的途径中分子保真度的丧失,该途径被选择来保护组织并赋予生殖优势。
端粒可防止滞后链中重要的DNA序列被除去
回想一下,真核细胞的线性DNA复制从复制起点开始就在两个方向上进行,原始DNA的每条链都被用作新拷贝的模板。因为DNA聚合酶只能在5′→3′方向,滞后链模板必须在冈崎片段上使用反向操作来完成染色体的复制。这种机制需要为每个新的冈崎片段合成RNA引物。因此,当DNA聚合酶到达染色体末端时,基本不会将滞后链的RNA引物替换为DNA。这通常称为末端复制问题。
在有丝分裂的真核细胞中,端粒解决了末端复制问题。端粒富含胸腺嘧啶(T)和鸟嘌呤(G),在真核生物界中高度保守,在新复制的人类DNA中,端粒的长度为5000-10000个碱基对。当DNA聚合酶到达滞后链模板上编码序列的末端时,它使用端粒作为RNA引物的模板,并开始合成冈崎片段(图4.34)。然而,由于反向合成机制,少量(10–50)端粒碱基对丢失。在复制过程中,端粒序列的这种微小损失可防止复制过程中染色体末端遗传物质的损失。
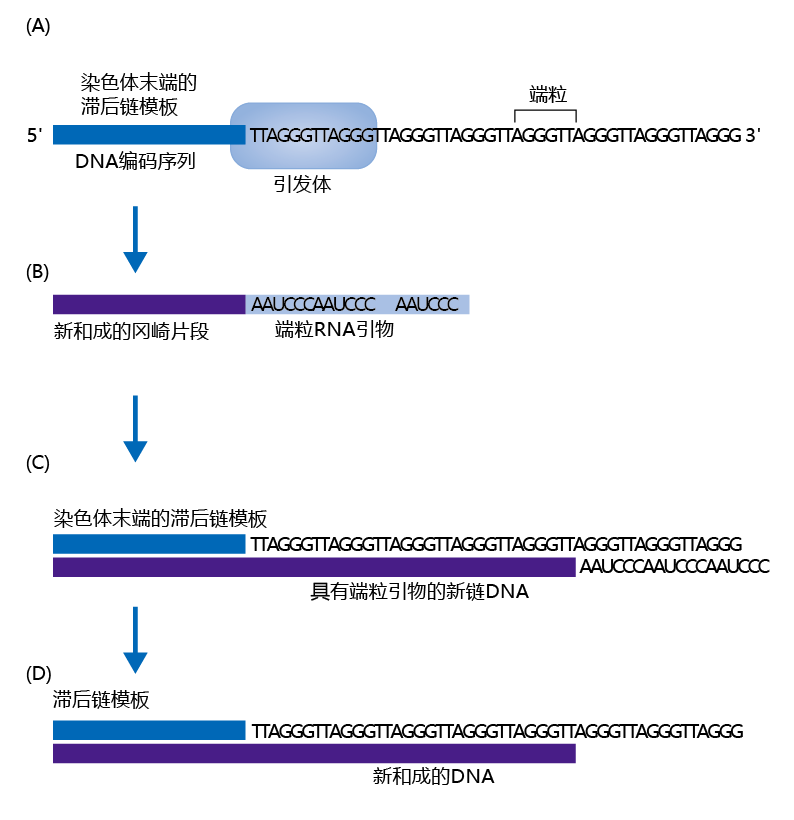
图4.34 端粒如何解决末端复制问题。(A)引发体(primosome)读取染色体末端滞后链模板上的端粒序列,(B)为下一个冈崎片段制作RNA引物。(C)然后将新合成的冈崎片段连接到新DNA的末端。(D) 最后,以端粒为模板合成的RNA引物被去除,新的DNA链就完成了。
由于滞后链模板上的复制导致端粒的一小段丢失,重复的细胞分裂可能导致端粒完全丢失。然而,在活跃的有丝分裂细胞中,端粒长度通过端粒酶的作用得以维持。
端粒酶具有独特的结构,既包含RNA亚基又包含蛋白质催化亚基(图4.35)。也就是说,端粒酶是一种携带自身RNA序列的酶。端粒酶的RNA亚单位包含该物种的端粒序列。就人类而言,RNA大约有450个核苷酸长,重复序列为AAUCCC(DNA序列,TTAGGG)。催化亚单位是一种逆转录酶(端粒酶逆转录酶,TERT),它是一种可以读取RNA序列作为模板并合成相应DNA序列的酶。
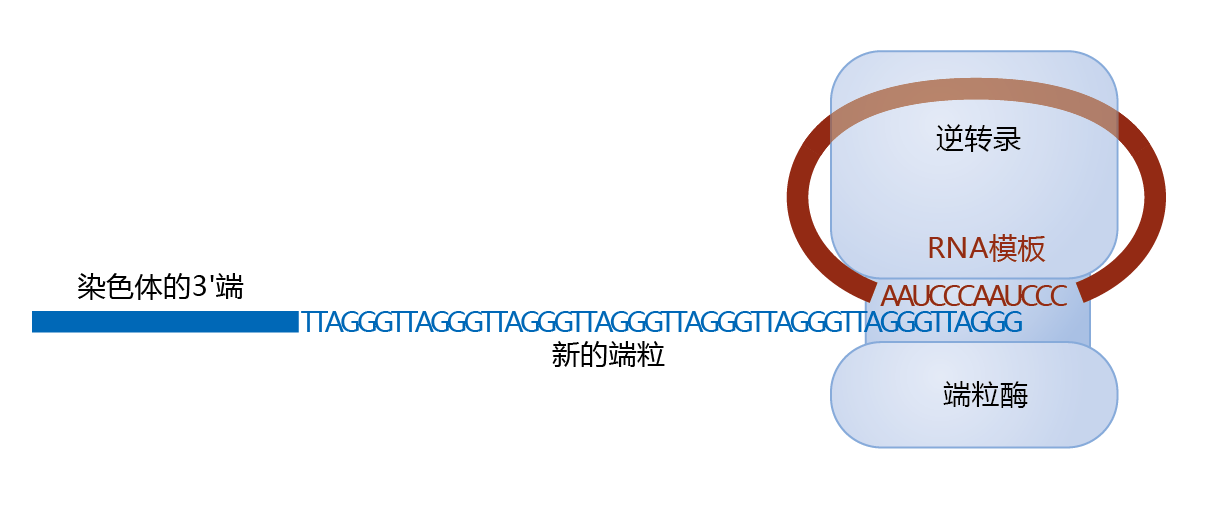
图4.35 端粒酶和端粒伸长。在S期的DNA复制之前,端粒酶被吸引到滞后链模板的3′端。端粒酶包含一种逆转录酶,这种酶可以以RNA为模板逆转录出DNA,此外端粒酶还含有合成DNA所需的RNA模板。
端粒伸长的机制确保了3′端比5′端长,这是适当的滞后链复制所必需的条件。然而,请注意,如果3′端保持原样,DNA修复机制可以将3′端的延长长度解读为双链断裂。端粒通过在3′端形成一个称为t环的环来解决这一潜在问题,这一过程称为帽端(end-capping),从而“愚弄”DNA修复机制,将其解读为双链(图4.36)。
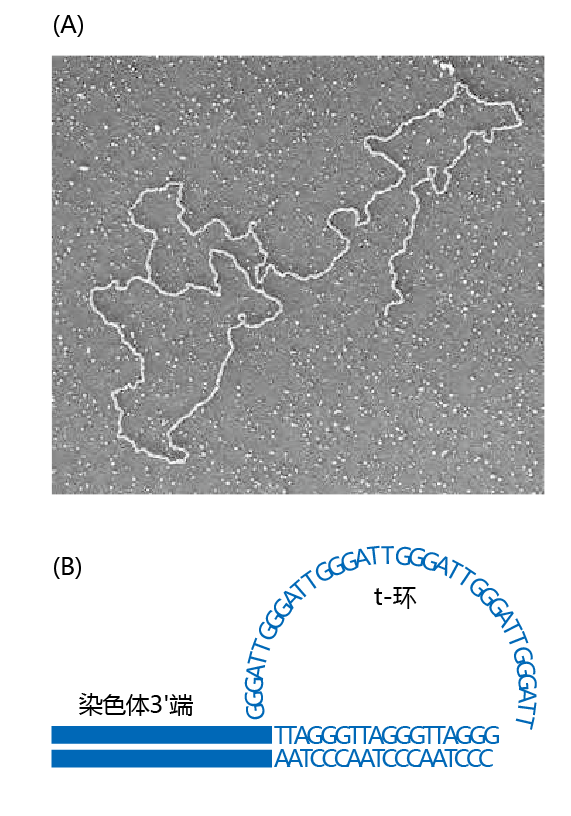
图4.36 端粒t环。(A)染色体末端t环的电子显微照片。(B)端粒的帽端,端粒用来阻止DNA双链断裂时3′延伸的可能读数(The end-capping of the telomere, a procedure used by the telomere to prevent the possible reading of the 3′ elongation as a DNA double-strand break.)。
端粒缩短可能导致体细胞衰老
端粒酶延长端粒发生在复制过程中需要高度保真度的细胞中。也就是说,端粒酶只在有限数量的细胞中表达,包括生殖系和干细胞。大多数有丝分裂体细胞通常不表达端粒酶,因此端粒缩短发生在这些细胞类型的每一次复制中。体外实验表明,衰老细胞的染色体端粒确实比在它们在衰老之前的染色体端粒更短。体细胞中端粒酶的缺乏和衰老细胞中较短的端粒的发现导致了被广泛接受的复制性衰老理论,即有丝分裂时钟理论,该理论预测老细胞会“感觉”到较短的端粒,这反过来会导致细胞周期停滞(图4.37)。
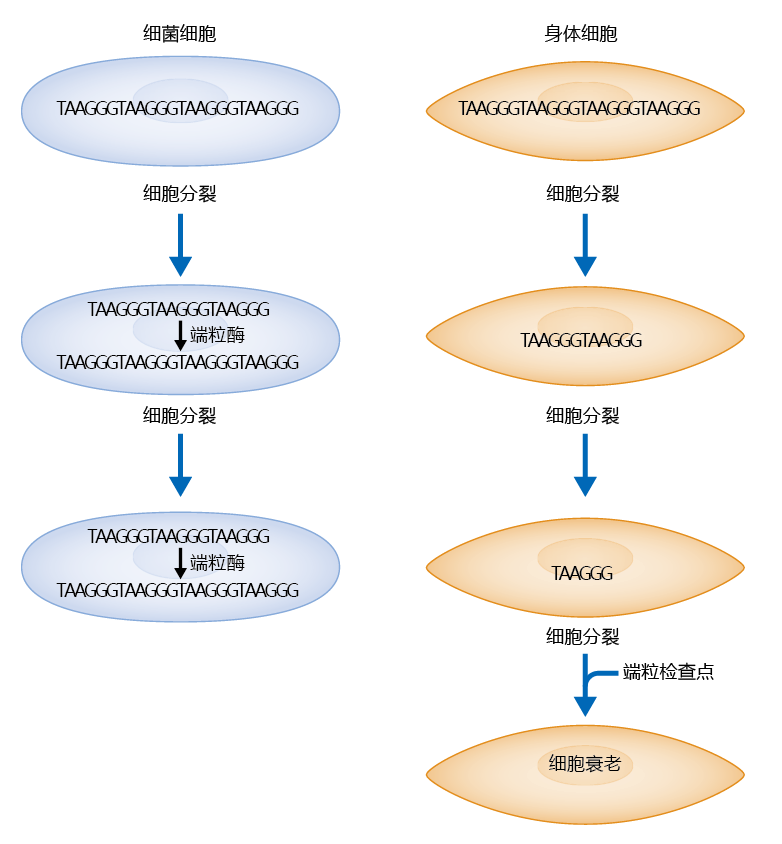
图4.37 细胞衰老的有丝分裂时钟理论。在生殖细胞和体细胞中,每次分裂后端粒都会缩短。在生殖细胞中,端粒酶补足了细胞复制过程中丢失的端粒。体细胞没有端粒酶,所以从滞后链上丢失的端粒不会被补足。在一个尚不清楚的机制中,当端粒检查点识别出极短的端粒时,细胞就会衰老。
尽管有丝分裂时钟理论的基础机制尚未被描述,但目前的研究表明,短端粒或无帽端粒可诱导细胞周期的抑制。这种抑制似乎遵循正常的细胞检查点,因为p53蛋白在衰老细胞中上调。图4.38显示了G1期端粒短或无帽可能导致衰老的一个例子。在数个复制周期后,体细胞中出现端粒短和无帽。DNA损伤和修复机制将端粒视为链断裂,并通过各种信号启动p53蛋白的磷酸化。抑制细胞周期蛋白Cdk复合物就会将细胞阻断在G1期。由于没有修复机制可以延长或给端粒加一个帽,也就是说,没有端粒酶,细胞会永久进入G0期,最终导致细胞衰老。
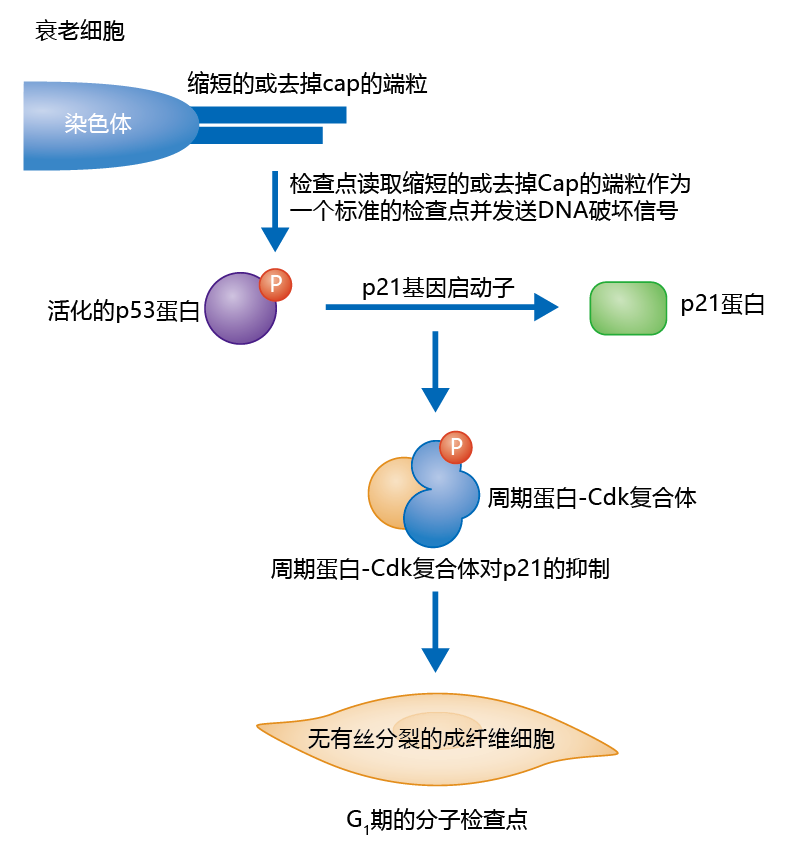
图4.38 细胞衰老的p53蛋白机制。如果有足够的时间和足够的细胞分裂次数,体细胞(那些没有端粒酶的细胞)中的端粒会缩短或变为无帽。DNA修复机制将短端粒或无帽端粒解读为链断裂。反过来,信号被传递到p53蛋白级联,细胞周期在G1停止,细胞永久进入G0。
有丝分裂钟理论也可能将衰老和长寿的进化基础预测与细胞衰老联系起来。回顾第3章,长寿的进化理论表明,体细胞的死亡率是由于体细胞DNA修复系统和生殖系之间的能量资源使用权衡的结果。很容易看出导致体细胞衰老的端粒缩短和生殖系中端粒的维持如何符合这类模型的范围。也就是说,生殖系在端粒酶上投入了大量的能量,以维持端粒和DNA复制的高度保真度,从而将基因转移到下一代。另一方面,体细胞在端粒延长方面没有投入任何资源,因为它们不表达端粒酶。请记住,一次性体细胞理论的一个基本原则是,体细胞只需要存活足够长的时间来支持成功的繁殖。虽然还没有被证实,但端粒似乎在告诉细胞它们该活到什么时候。
短的端粒与时间依赖性功能丧失和病理相关
我们已经发现,端粒的进行性丢失会导致细胞衰老和组织功能障碍。那么,问题就变成了“端粒缩短导致的细胞衰老是如何导致时间依赖性功能丧失的?”尽管这个问题的答案仍有待完全阐明,但大多数研究指出了端粒相关细胞衰老可能导致组织和器官功能随时间变化的三个可能原因。首先,随着时间的推移,衰老细胞在有丝分裂组织中积累。由于衰老细胞处于永久性生长停滞状态,它们不会从组织中移除,导致组织无法更新为健康、功能正常的细胞。当端粒相关衰老细胞在干细胞中发生时,因为端粒缩短引起的衰老细胞的积累所造成的有害影响尤其有害。随着时间积累,衰老细胞加剧了SASP(见前面的讨论),进而增加了炎症和组织损伤。SASP招募到该区域的免疫细胞将影响邻近细胞的功能,进而增加炎症和组织损伤。
最后,几项研究证明了端粒长度与病理之间的相关性。在患有心血管疾病、肝硬化、II型糖尿病、骨质疏松症和癌症的老年患者的细胞中发现了短端粒。然而,端粒短是否与这些疾病的病因有关,或者端粒短是疾病的结果,还有待观察。这个问题对于具有重要环境成分的疾病特别重要,如本文所列的疾病。我们现在知道,长期暴露于病原体和不健康的生活方式会增加端粒短的风险。吸烟、酗酒、肥胖和不运动是老年常见疾病的主要危险因素,包括这里提到的那些。


