5.4 酿酒酵母寿命的遗传调控
单细胞真核生物酿酒酵母多年来一直被用于衰老研究。它是这项研究的模式生物,因为它寿命短,生长和维护成本低,并且具有良好的遗传学和生理学特征。最常见的酵母通常被称为啤酒酵母或面包酵母,酿酒酵母是第一个进行基因组测序的真核生物(1996年完成)。它的每个染色体组含有16条染色体,DNA序列中有12,495,568个碱基对。已知基因约有5000–6000个,平均大小为490个密码子(1.47 kbp)。这种酵母的基因组是紧凑的,75%的DNA序列是外显子。尽管研究人员已经确定了许多具有影响寿命的突变的酵母菌株,但其中只有少数菌株经过了足够详细的筛选,值得在此讨论。与酿酒酵母寿命相关的遗传机制包括基因组不稳定、基因沉默和营养应答途径(nutrient-responsive pathways)突变。在本节中,我们将更详细地了解每一种酵母,但首先我们需要简要讨论酵母如何繁殖,因为它的繁殖周期会影响其寿命。
酿酒酵母无性繁殖和有性繁殖
酵母可以以两种染色体状态存在,一种是二倍体(包含两组染色体),另一种是单倍体(仅包含一组染色体)。单倍体细胞以有丝分裂的方式繁殖,通过出芽从母细胞中产生一个新的细胞。在出芽过程中,母细胞的细胞核经历有丝分裂形成子细胞核,子细胞核迁移到形成的芽中(图5.28A)。几丁质是一种坚韧的含氮糖聚合物,形成于芽和母细胞之间。当有丝分裂完成时,新的子细胞与母细胞分离(图5.28B)。分离后,被称为芽痕的圆形几丁质残余物永久地留在母细胞表面。二倍体繁殖是偶然发生的,至少部分受环境条件的影响。萌芽产生两种类型的子细胞,a和α。如果两种相反的交配类型相遇,它们可以融合并进入细胞周期的二倍体阶段。在有利于子细胞存活的环境条件下,二倍体酵母通过有丝分裂或出芽繁殖。然而,如果环境条件使得子细胞的生存受到威胁,二倍体酵母会产生四个配子,称为子囊孢子,其中两个带有a染色体,两个带有α染色体。当环境条件更有利时,孢子萌发并产生四个单倍体酵母细胞。
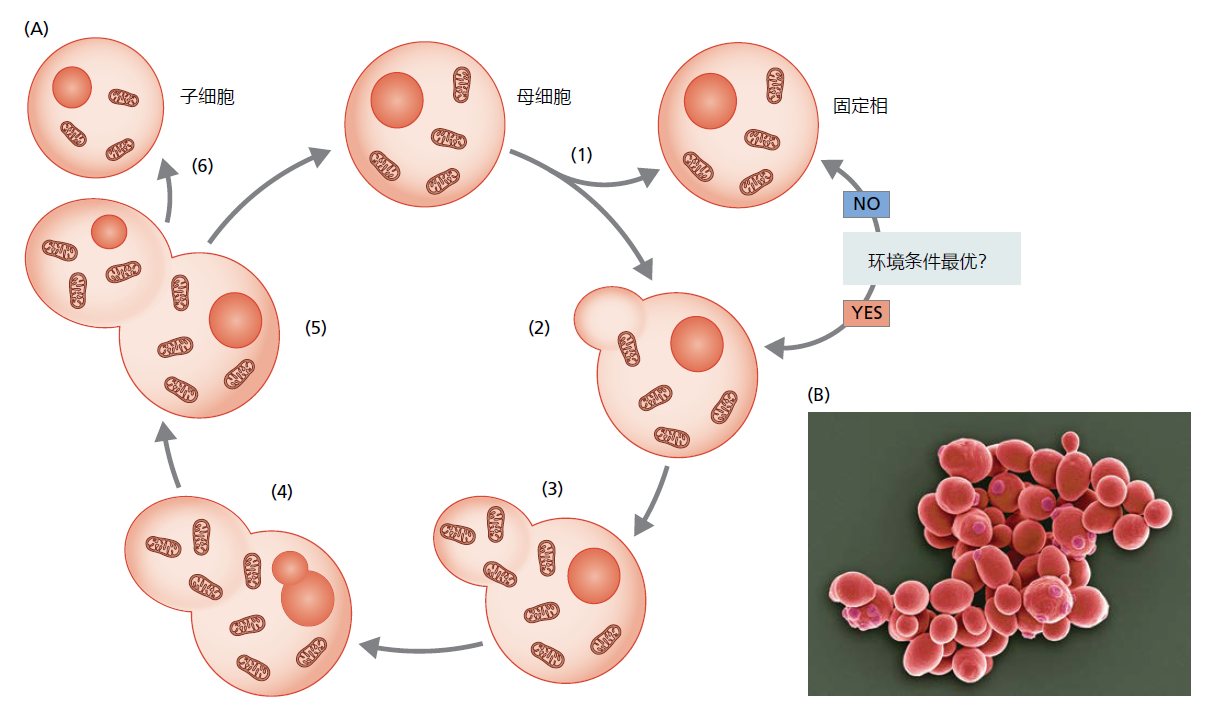
图5.28 酿酒酵母的无性生殖周期。(A)无性繁殖是通过萌芽进行的。(1)母细胞可以感知环境条件是否适合繁殖。如果它们不是最佳的,母细胞可能会进入稳定期,直到条件改善。(2)如果环境条件适合繁殖,母细胞细胞质会延伸,进而形成芽。(3)新的细胞质细胞器被合成并迁移到新形成的芽中。(4)有丝分裂开始,遗传物质被复制,一个新的细胞核从母核分裂出来。(5)新形成的细胞核迁移到芽中。(6)出现细胞分裂,母细胞和子细胞分离。(B)新酵母细胞(子细胞)的扫描电子显微照片,在母细胞上形成芽。母细胞产生的子细胞数量,是通过分离后在母细胞上面留下的疤痕(scar)数量来表示的,这些疤痕是由于产生子细胞留下的,这些疤痕数量提供了生殖衰老的量度。注意新分离的子细胞的尺寸较小。(B,由S.Gschmeissner/Getty图片社提供。)
芽接酵母的生命史可以用Gompertz死亡率方程来描述,该方程将单细胞真核酵母中的复制性衰老与多细胞生物组织的有丝分裂细胞区分开来。如图5.29所示,芽痕的数量和母细胞的大小为估计母细胞的生殖年龄提供了方便的标记。在进入复制衰老之前,单个酿酒酵母平均产生20-30个新的子细胞(20-30个芽痕)。然而,芽痕的数量和母细胞的大小都不是衰老的直接原因。增加芽痕数量、细胞大小或两者的突变不会影响寿命。
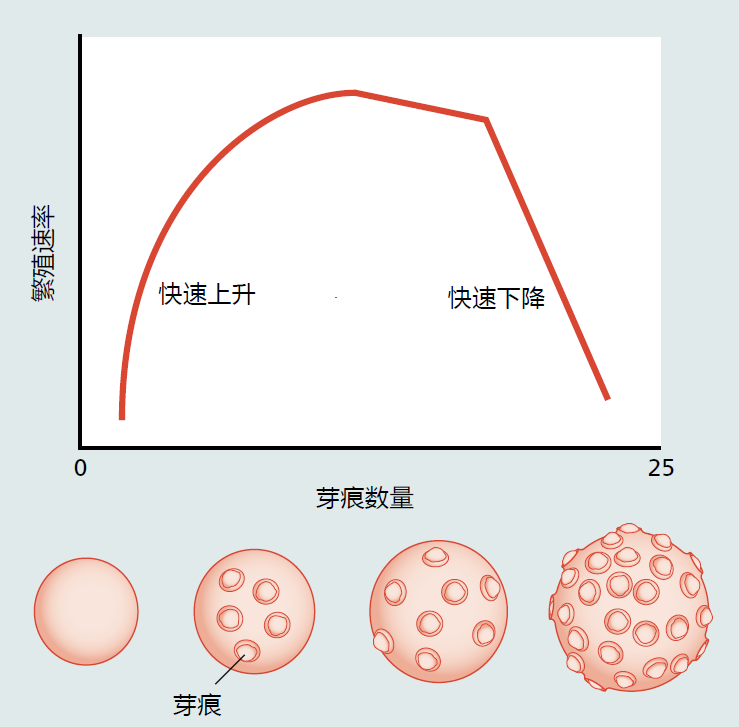
图5.29 酿酒酵母的芽痕和复制衰老。一个年轻的酵母细胞很小,几乎没有芽痕,而且发芽速度很快。如图所示,最初的繁殖期之后是一个稳定繁殖率的延长期。当酵母接近其最大发芽数时,繁殖迅速下降,生物体死亡。(译者注:会不会是芽痕的出现阻碍了酵母细胞和外界物质交换,芽痕变多,当物质交换效率持续下降到临界值时,酵母细胞死亡。有的酵母细胞代谢效率低,允许更多的芽痕,而有的不是。)
环境条件影响繁殖和寿命
在第3章中,我们发现周围环境对单细胞生物(如酿酒酵母)种群的生命史模式和成功繁殖有显著影响。酿酒酵母的生活史显示了与野生单细胞种群相关的典型模式:(1)当资源(食物、空间等)充足时,种群数量迅速增加;(2) 当资源匹配内在增长率时,种群停止增长 (r = 繁殖率 − 死亡率 = 0);(3) 随着资源开始减少,种群数量减少(繁殖减少);以及(4)当资源耗尽时种群出现复制性衰老和死亡。
酿酒酵母有两种繁殖策略,有助于延长其繁殖寿命,并在环境资源有限或耗尽时防止种群死亡。二倍体酵母的有性繁殖产生子囊孢子,子囊孢子可存活数年,并能承受多种不同类型的环境条件。这样可以忍受长期的环境压力。单倍体酵母的出芽为延长生殖期提供了短期解决方案。当芽接酵母检测到环境条件对子细胞的存活有害时,无性繁殖(芽接)被关闭。芽接酵母进入非分裂状态,称为静止期,但仍保持代谢活性。如果环境条件在1-2周内改善,酵母恢复生殖活动;否则,细胞死亡。在静止阶段,酵母在寿命结束时氧自由基水平显著升高。在这个阶段,没有超氧化物歧化酶(SOD)基因的突变酵母细胞具有更短的寿命,而过度表达SOD的突变体具有更长的生殖后寿命。非分裂酵母中氧自由基的增加似乎会刺激p53检查点蛋白,进而触发类似凋亡的死亡。非分裂酵母的衰老特征和复杂的多细胞生物很相似,因此为研究人员提供了一种简单的真核生物来研究长寿遗传学。
DNA结构改变影响寿命
解释芽接酵母复制衰老的遗传机制在很大程度上仍然是未知的。然而,因为DNA结构改变而引起的基因组不稳定性似乎在酵母寿命中起着重要作用。与衰老酵母相关的基因组不稳定性发生在核仁中的核糖体DNA(rDNA)中。酵母rDNA基因座是染色体XII上的一个片段,包含100–200个9 kbp的重复序列,串联排列,编码rRNA。rDNA的重复性使这些区域极易发生染色体内同源重组,也称为一般重组。尽管一般重组是减数分裂的重要组成部分,但酵母中的这一过程也会导致潜在的破坏染色体之外的rDNA环(ERC),图5.30有显示。ERC包含复制起始位点,因此可以自我复制,导致这些结构在母酵母中积累。ERCs的积累与复制性衰老高度相关,虽然ERCs如何导致复制性衰老尚未得到证实。酿酒酵母的研究表明,ERCs的产生和随后的复制衰老可能与基因表达调控的乙酰化脱乙酰化机制有关。
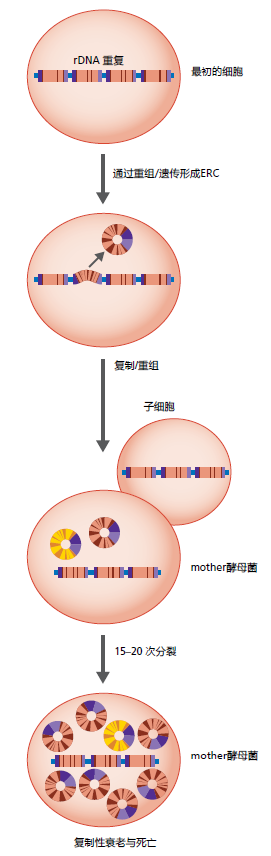
图5.30 ERC的形成和酵母复制性衰老。芽接酵母含有高度重复的rDNA序列,呈串联出现,通过一般重组形成ERCs。每一轮出芽后,ERCs在母细胞中形成。ERCs的积累与酵母的复制性衰老和死亡有关。
ERCs是一种“生物钟”,与酿酒酵母的寿命有关。这一结论是两个发现的结果。首先,含有阻止ERC形成的突变的芽接酵母比野生型酵母活得更长。第二,从年老的母酵母细胞中产生的子细胞接受ERC,其寿命明显短于不含ERC的子酵母。
SIR2 通路与长寿相关
让rDNA沉默,不转录成rRNA似乎受到一个高度保守的基因的调控,该基因名为沉默信息调节器2(sir2)。sir2的过度表达使得rDNA表达减少和ERC形成减少。sir2的过度表达使酵母的复制寿命加倍。sir2基因及其编码蛋白(SIR2)延长酵母复制寿命的方式尚未完全确定。现在我们知道SIR2蛋白是一种组蛋白去乙酰化酶,它可以让染色质的压缩和基因沉默。
SIR2诱导的基因沉默似乎与将食物转化为能量的途径直接相关。如第4章所述,葡萄糖氧化产生的电子通过电子载体穿梭到ATP合成装置。其中一种载体,氧化型烟酰胺腺嘌呤二核苷酸(NAD+),激活或“开启”SIR2蛋白。因此,细胞中NAD+浓度直接影响SIR2活性的水平;低浓度NAD+使SIR2蛋白失活;高浓度NAD+激活SIR2蛋白。NAD+浓度随酵母环境中食物的量而波动。充足的时间使得繁殖增加和代谢活动率相对较高。反过来,代谢途径产生增加的电子流和较低的NAD+与NADH+H+比率(图5.31)。因此,SIR2蛋白的活性下降,rDNA被转录,繁殖(萌芽)进行。相反,当食物变得稀缺时,新陈代谢降低,由此产生的电子流减少,从而提高了NAD+与NADH+H+的比率。反过来,NAD+与SIR2结合,使组蛋白去乙酰化酶的激活和染色质的压缩,rDNA基因座沉默,萌芽过程的减少,酵母的复制寿命延长。
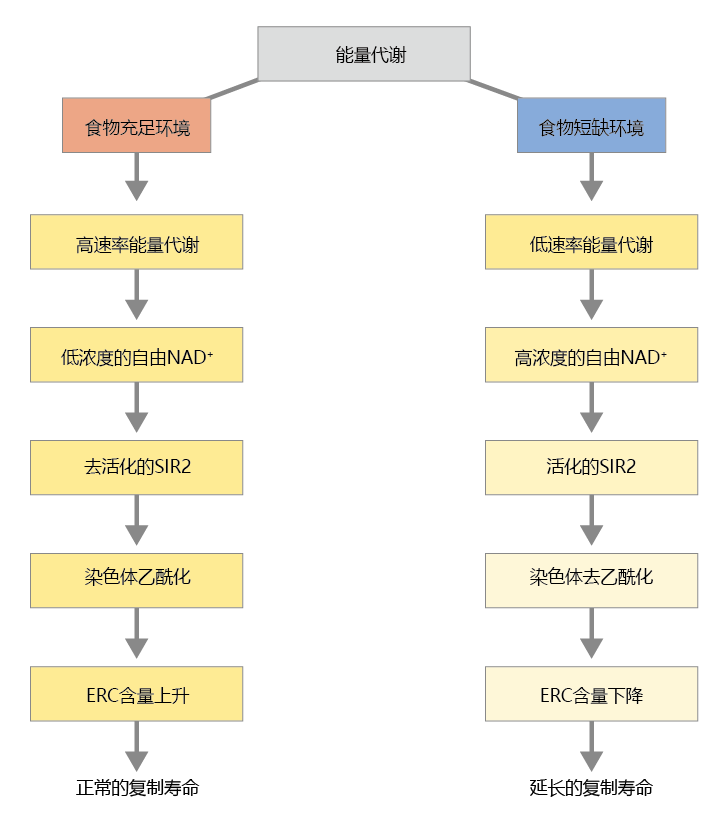
图5.31 酿酒酵母的能量代谢与延长寿命联系起来的导向机制。充足的时间会导致繁殖增加和代谢活动率相对较高(左)。在食物供应不足和繁殖率低的时期,酵母中的能量代谢降低(右),导致rDNA转录减少、出芽减少并且抑制ERC的形成。
营养反应途径中的功能缺失突变可能延长寿命:雷帕霉素的靶点
在最后一节中,我们展示了表观遗传机制,组蛋白乙酰化和脱乙酰化如何调节寿命。我们现在研究一种遗传可以将酿酒酵母的营养有效性与寿命联系起来的机制,该机制是雷帕霉素(mTOR)的机制靶标。请记住,mTOR基因仅仅是酵母中200多个被证明的可以调节寿命的基因中的一个。我们选择mTOR作为这些基因的一个例子进行讨论,主要原因有两个:(1)越来越多的证据表明,mTOR等基因通过营养感应参与生长和繁殖;(2)mTOR对寿命的影响从酵母到小鼠似乎高度保守,这表明人类可能存在类似的寿命影响。
mTOR基因和代谢途径得名于一种名为雷帕霉素(又称西罗莫司)的免疫抑制剂,该药物在器官移植后被广泛用作组织抗排斥剂(图5.32)。雷帕霉素的结合靶标是在20世纪90年代通过基因筛选发现的,该筛选是寻找对雷帕霉素有抗性的酿酒酵母菌株。随后对mTOR基因的克隆表明,它的作用模式是基于营养物质的有效性来调节细胞生长。充足或过量的营养物质,主要是酵母中的葡萄糖,导致mTOR基因的表达,进而促进细胞生长和繁殖。缺乏营养物质的酿酒酵母会抑制mTOR的表达,导致细胞生长和繁殖减慢。
图5.32 雷帕霉素(西罗莫司)的结构。(Shutterstock提供。经许可。)
mTOR基因编码一种高度保守的蛋白激酶,它参与两种不同但相关联的代谢途径,mTOR1(图5.33)和mTOR2。我们在此讨论mTOR1途径。mTOR2途径将在下一节中介绍。简言之,充足的营养或细胞内充足的能量状态导致mTOR与一种称为RAPTOR的蛋白质(一种支架蛋白)一起表达。
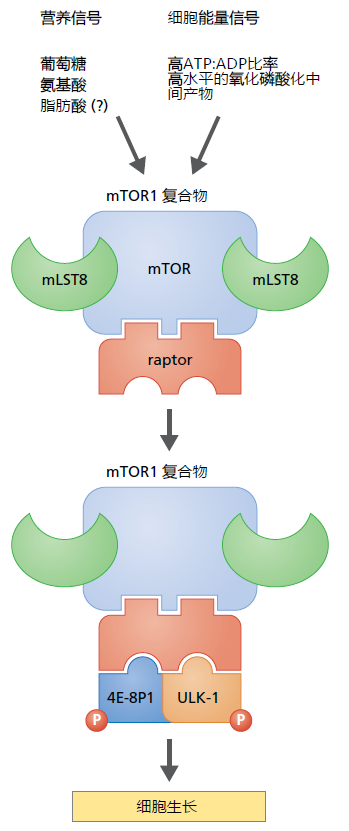
图5.33 mTOR1调节细胞生长的途径。充足的营养物质可用性、细胞的高能量状态或两者都会导致mTOR1复合物的形成。mLST8和PRAS40蛋白有助于稳定mTOR蛋白,以使RAPTOR与胞浆蛋白4E-BP1和ULK-1结合。4E-BP1与ULK-1分别是作用于蛋白质翻译和细胞自噬的抑制蛋白。这些抑制蛋白的磷酸化标志着它们的降解,并导致正常的细胞生长。
支架(scaffold)蛋白为核心蛋白(在本例中为mTOR)与其靶蛋白的结合提供了空间。另外两种蛋白PRAS40和mLST8也是mTOR激活所必需的,尽管它们在mTOR1复合物中的确切作用仍有争议。mTOR1复合物结合靶点是控制核糖体蛋白翻译和溶酶体自噬的各种胞浆蛋白,这是细胞正常生长所需的两个关键功能。
充足的营养供应导致mTOR1复合物对各种胞浆蛋白的磷酸化,细胞生长和繁殖正常进行。低营养素可用性和/或较少的细胞内能量就可以抑制mTOR1复合物的形成。控制蛋白质翻译和自噬的胞浆蛋白不被磷酸化,细胞生长和繁殖受到抑制。
根据Hamilton的自然选择力对死亡率的预测,mTOR途径抑制,使得细胞生长和繁殖减慢,从而延长了酵母寿命(参见第3章,标题为“Hamilton的自然选择力对死亡率影响完善了Medawar理论”的章节;另见图3.10)。几个实验室已经通过开发缺乏mTOR基因或与mTOR1复合物结合的蛋白质之一的突变酵母菌株来测试这一预测。如图5.34所示,mTOR的缺失显著增加了复制寿命和按时间顺序的寿命,支持了进化预测。类似的抑制mTOR途径的实验(在随后的章节中描述)证明了秀丽隐杆线虫、果蝇和小鼠的寿命延长。
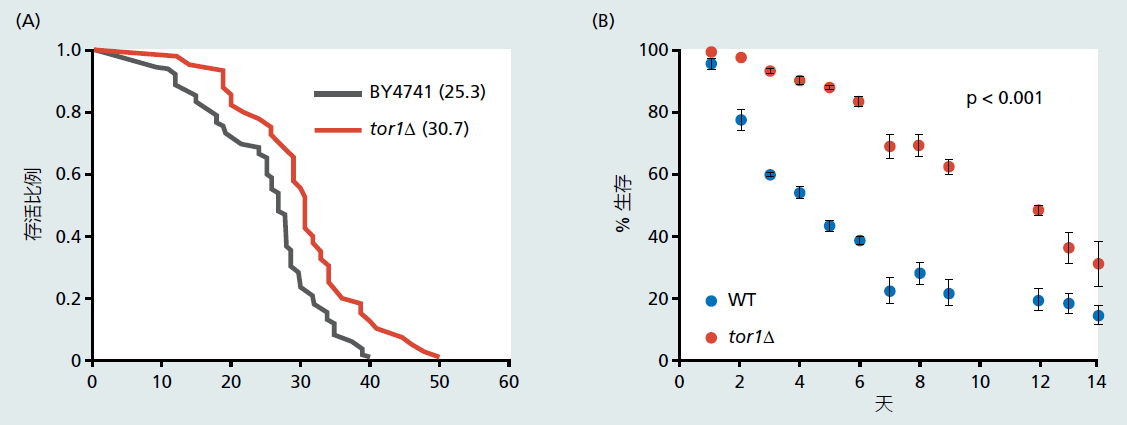
图5.34 酿酒酵母mTOR敲除(tor1Δ)型和野生型([A]:BY4741;[B]:WT)的复制寿命(A)和按时间顺序的寿命(B)。图A中括号的数字和图B中的线显示了平均复制寿命。酵母复制寿命是母细胞周期停止前产生的子细胞数量。按时间顺序的寿命是指酵母细胞在静止阶段保持存活的天数。(摘自:A,Kaeberlein M et al.2005。Science 310:1193。经AAAS许可;B,Bonawitz ND et al.2007。Cell Metab 5:265。经Elsevier许可。)


