5.7 小家鼠寿命的遗传调控
简单的生物,例如酿酒酵母和秀丽隐杆线虫,提供了有价值的信息,以支持繁殖、发育和寿命相互联系的可能性,这反过来支持衰老的进化理论。这些对衰老和长寿生物学的见解在对更复杂的果蝇的研究中得到了进一步的支持。现在我们把注意力转向普通的实验室老鼠。小家鼠的基因组有25亿个碱基对,包含在19对常染色体和1对性染色体中。小鼠中约有23000个基因,占整个碱基对序列的4%。
转基因小鼠的使用大大增加了我们对影响寿命的遗传途径的理解。总的来说,使用转基因小鼠进行寿命研究的结果与酿酒酵母、秀丽隐杆线虫和果蝇的研究结果一致。也就是说,经过基因改造之后,小鼠比野生型动物活得更长,改造的基因抑制了对正常生长重要的神经内分泌途径。本节探讨这些调查的结果。首先,我们简要介绍了生物衰老学家在确定哪些基因影响寿命以及哪些基因在减缓衰老速度和延缓与年龄相关的疾病方面可能发挥更大作用方面面临的挑战。
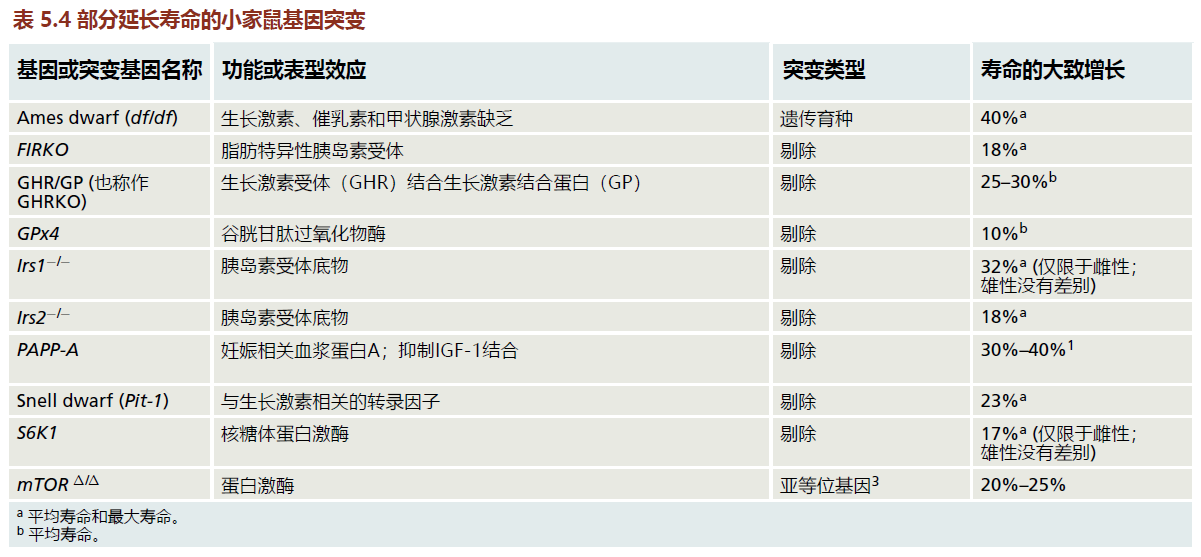
据报道,许多小家鼠基因会影响寿命
随着重组DNA技术的自动化和商业化,非遗传学家能够相对容易地构建基因剔除以及转基因小鼠。科学家评估许多转基因小鼠在生物衰老学研究中的作用。30至40种不同的基因已被鉴定为对小鼠的寿命有一定影响(表5.4)。已经开发了几种转基因小鼠,以评估在酿酒酵母、秀丽隐杆线虫和黑腹果蝇中鉴定的长寿基因或与这些基因相关的信号通路是否也能延长哺乳动物物种的寿命。其他基因修改的小鼠已经被开发出来,以评估已知在特定疾病过程中起作用的基因是否也在寿命差异中起作用。
 近年来,评估单个基因对小鼠寿命影响的研究的虚拟实验(virtual explosion)在生物衰老学领域取得了重大进展。在解释和确定这项研究与长寿研究的相关性方面,它也带来了重大挑战。许多研究表明,基因(转基因菌株)的过度表达或基因(敲除)的消除会延长寿命,但这些研究未能遵循第2章所述的动物护理标准和生物衰老学使用程序、住房条件的细节不足以及缺乏病理学数据(见方框2.1)。这些缺陷包括:没有足够的动物数量进行适当的统计分析,仅对一种性别进行研究,住房条件的细节不足以及缺乏病理学数据。缺乏的病理学数据和可能的死亡原因可能是确定基因在延长寿命方面的相关性的最重大的挑战。由于所有与长寿相关的基因都是高度多效性的,因此基因的过度表达或消除可能会对免疫和疾病产生影响。例如,一项缺乏病理学数据的研究列出了敲除小鼠和对照组之间的八种不同表型差异。如果没有对病理学、可能的死亡原因或两者的描述,就无法确定基因是否影响了寿命本身,即遗传效应,或者这些差异是否是因为衰老速率的改变或疾病预防的随机效应。
近年来,评估单个基因对小鼠寿命影响的研究的虚拟实验(virtual explosion)在生物衰老学领域取得了重大进展。在解释和确定这项研究与长寿研究的相关性方面,它也带来了重大挑战。许多研究表明,基因(转基因菌株)的过度表达或基因(敲除)的消除会延长寿命,但这些研究未能遵循第2章所述的动物护理标准和生物衰老学使用程序、住房条件的细节不足以及缺乏病理学数据(见方框2.1)。这些缺陷包括:没有足够的动物数量进行适当的统计分析,仅对一种性别进行研究,住房条件的细节不足以及缺乏病理学数据。缺乏的病理学数据和可能的死亡原因可能是确定基因在延长寿命方面的相关性的最重大的挑战。由于所有与长寿相关的基因都是高度多效性的,因此基因的过度表达或消除可能会对免疫和疾病产生影响。例如,一项缺乏病理学数据的研究列出了敲除小鼠和对照组之间的八种不同表型差异。如果没有对病理学、可能的死亡原因或两者的描述,就无法确定基因是否影响了寿命本身,即遗传效应,或者这些差异是否是因为衰老速率的改变或疾病预防的随机效应。
科学家们试图通过对转基因小鼠的研究来确定长寿结果的相关性,面临的另一个挑战是缺乏对这一发现的重复实验。重复实验以确认数据的准确性是科学方法的基石;如果没有重复实验,结果必须被认为是初步的。在寿命较短的物种中,即酿酒酵母、秀丽隐杆线虫和果蝇,数百项长寿实验可以在几年内完成,只需对生物的住房和护理投入很少。相比之下,在小鼠身上进行两次长寿实验需要近10年的时间,住房和护理费用超过13万美元。最常用的非基因突变小鼠C57BL/6的平均寿命为26至28个月;最大寿命可长达40个月。基因改变的C57BL/6小鼠通常引起寿命增加约25%。这意味着最大寿命可能长达50个月(4年)。此外,在为长寿研究设计的设施中安置一只老鼠的平均成本可能会超过400美元。考虑对小鼠进行寿命调查,每组四组,每组40只(大多数统计学家认为这是进行寿命分析所需的最小数量);仅住房成本就要64000美元。
这些与许多使用基因操纵小鼠的长寿研究相关的方法论问题并没有降低它们对生物衰老学的重要性。这些方法论问题只是使它们不太适用于长寿研究。许多转基因和基因敲除株已经对与年龄相关的疾病的潜在机制提供了重要的证据。然而,这里我们关注的是长寿的遗传学,这一过程与导致年龄相关疾病的过程明显不同。出于这个原因,我们此处只讨论那些不受物种影响的提高寿命的基因,或者那些不受特定病理学影响的基因。
胰岛素信号传导降低导致生长迟缓和寿命延长
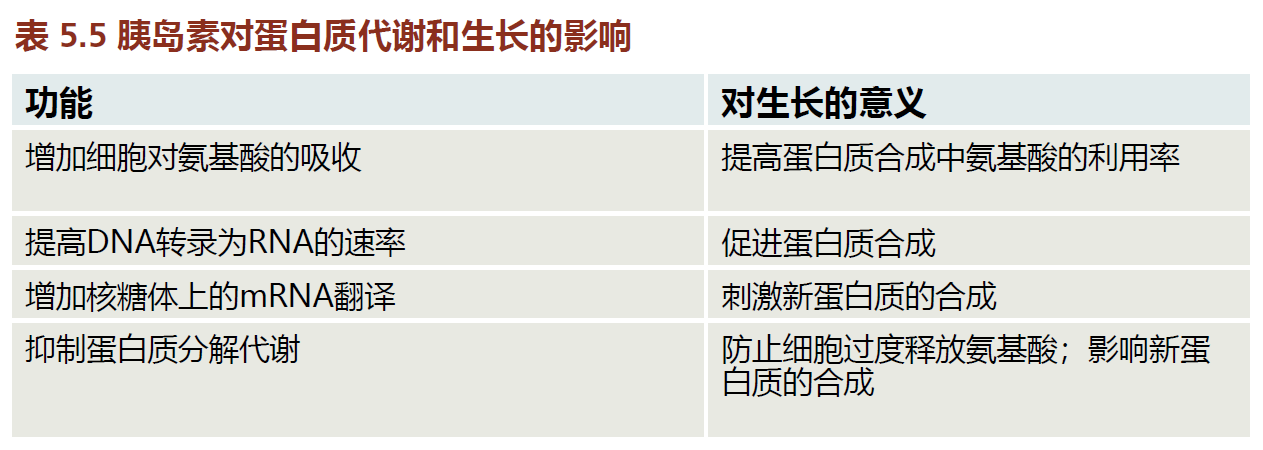
回想一下,秀丽隐杆线虫和果蝇的靶向胰岛素/IGF-1样信号通路的敲除突变会延缓发育、生长或两者都影响,并延长寿命。这些结果很重要,因为影响生长的胰岛素信号通路在系统发育上高度保守,并且在脊椎动物和无脊椎动物中都有(表5.5)。因此,抑制小鼠的胰岛素信号也可能延长寿命。
 如果删除小鼠编码细胞内信号蛋白和胰岛素受体基因,那么就可以延长小鼠的寿命,在秀丽隐杆线虫和果蝇中也有类似发现。与秀丽隐杆线虫和果蝇的基因敲除一样,这两种转基因小鼠都比野生型小鼠小得多。这再次表明,生长迟钝与长寿之间有着密切的关系。在一系列研究中,一种编码胰岛素受体结合的主要的细胞内效应物(effector,一种引起效应的药剂)基因被剔除,这种效应物称作胰岛素受体底物1(Ins1)。在敲除小鼠中观察到的寿命增加仅见于雌性。转基因小鼠寿命的性别差异并不罕见,其原因仍有待观察。
如果删除小鼠编码细胞内信号蛋白和胰岛素受体基因,那么就可以延长小鼠的寿命,在秀丽隐杆线虫和果蝇中也有类似发现。与秀丽隐杆线虫和果蝇的基因敲除一样,这两种转基因小鼠都比野生型小鼠小得多。这再次表明,生长迟钝与长寿之间有着密切的关系。在一系列研究中,一种编码胰岛素受体结合的主要的细胞内效应物(effector,一种引起效应的药剂)基因被剔除,这种效应物称作胰岛素受体底物1(Ins1)。在敲除小鼠中观察到的寿命增加仅见于雌性。转基因小鼠寿命的性别差异并不罕见,其原因仍有待观察。
另一只显示寿命延长的转基因小鼠缺少了编码脂肪组织特有的胰岛素受体的基因,即脂肪特异性胰岛素受体剔除(FIRKO)。FIRKO小鼠的寿命增加(图5.45),尽管再次证明了胰岛素信号通路与寿命之间的密切关系,但也表明脂肪储存的减少可能会影响寿命。除了在生长中的作用外,胰岛素还会增加进入脂肪细胞的葡萄糖量。虽然只有极少量的葡萄糖转化为脂肪,但葡萄糖为甘油提供了碳骨架,甘油是甘油三酯的主要成分,甘油三酯是脂肪组织中脂质的主要储存形式。由于FIRKO突变体的脂肪组织缺乏胰岛素受体,这些小鼠的脂肪组织数量有限,脂肪组织的缺乏解释了它们体型较小的原因。第9章和第10章讨论了肥胖对死亡率的主要影响,以及健康的体重如何降低一个人患许多与年龄相关疾病的风险。
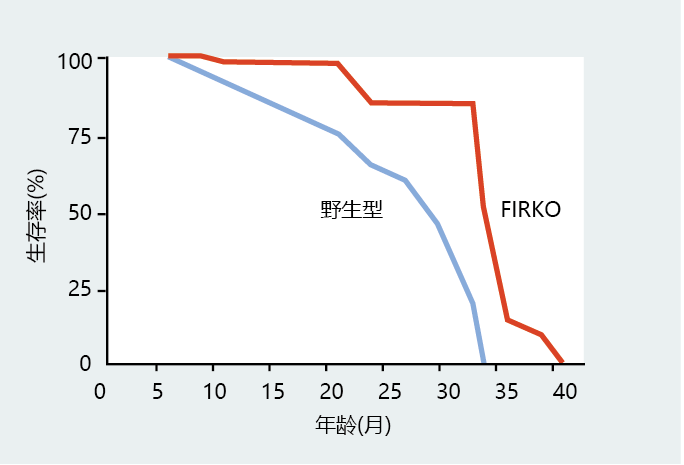
图5.45 胰岛素信号通路的衰减增加了寿命。雄性和雌性小鼠、野生型和FIRKO(缺少脂肪特异性胰岛素受体基因的剔除突变体)的存活曲线。(改编自Bluher M等人,2003年。科学299:572–574。经AAAS许可。)
生长激素信号通路减弱与胰岛素样信号通路与延长寿命相联系
在秀丽隐杆线虫、果蝇和肌肉中,由于胰岛素或胰岛素样信号通路的破坏而导致的体型减小,并引起寿命延长是高度保守的。哺乳动物中的胰岛素和胰岛素样信号通路是影响生长和发育的更大调控系统的一部分,涉及垂体分泌的生长激素(图5.46)。因此,突变导致生长激素信号中断,从而导致小鼠生长发育迟缓,从而延长寿命,这不足为奇。
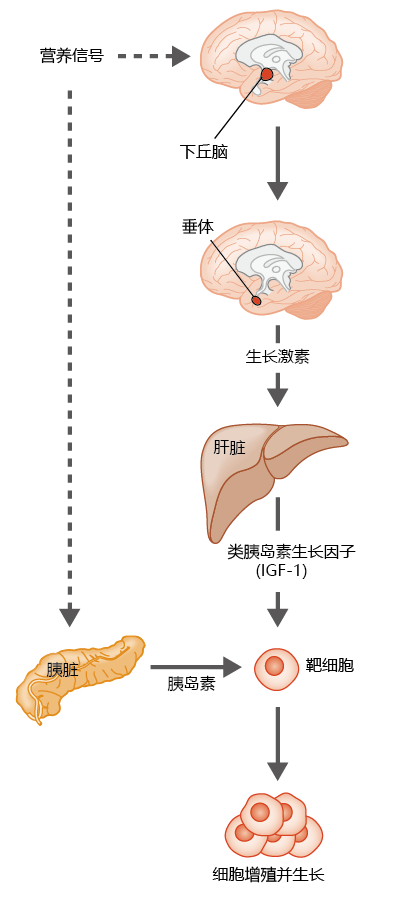
图5.46 哺乳动物生长激素/胰岛素样信号通路的简化描述。下丘脑向位于下丘脑下方的垂体发出信号,引起生长激素分泌到血液中。生长激素刺激肝脏合成胰岛素样生长因子1(IGF-1),该因子被释放到全身循环中。同时,营养信号使胰腺分泌胰岛素进入全身循环。胰岛素和IGF-1一起诱导生物体的有丝分裂和生长。
三种侏儒(dwarf )突变体——Ames侏儒、Snell侏儒(Pit-1)和GHR/GP(也称为GHRKO,生长激素受体剔除)——都具有生长激素引发的细胞内信号传导中断,与野生型菌株相比,这会引起体型变小和寿命延长(图5.47和5.48)。Ames侏儒和Snell侏儒突变体具有高度多效性,引起血液中生长激素、催乳素和甲状腺激素的浓度降低。GHR/GP突变体在其他激素中没有表现出变化,但像Ames侏儒和Snell侏儒一样,它的血液中IGF-1浓度降低。

图5.47 GHR/GP剔除小鼠与野生型和杂合子小鼠的对比。注意,GHR/GP剔除小鼠(–/–)比正常(+/-)和杂合(+/+)同窝小鼠小。这三种基因型的大小差异与其他侏儒小鼠品种Ames和Snell的大小相似。(摘自Coschigano KT等人,2000年。内分泌学141:2608-2613。经内分泌学会许可。)
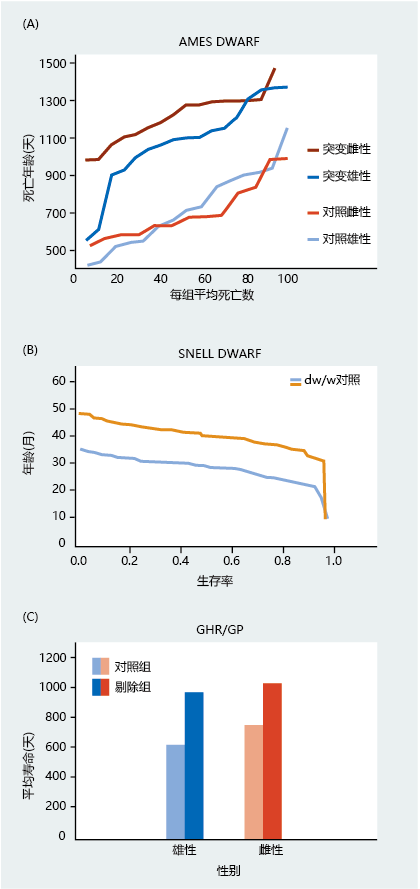
图5.48 小鼠三种侏儒基因型的寿命。(A) Ames侏儒、(B)Snell侏儒和(C)GHR/GP突变体。在Ames侏儒和GHR/GP突变体中,雌性的寿命明显大于雄性。对于Snell侏儒,只评估了雄性。(A,改编自Brown Borg HM等人,1996年。《自然》384:331996。经麦克米伦出版社许可;B、 改编自Flurkey K等人2001。《美国国家科学院院刊》98:6736–6741。经PNAS许可;C、 Coschigano KT等人2000年的数据。内分泌学141:2608-2613。经内分泌学会许可。)
侏儒突变似乎减缓了衰老的速度,延缓了某些与年龄相关的疾病的发病。例如,胶原蛋白变性所需的时间被证明是小鼠衰老速度的指标。这是因为,一旦合成,尾巴中的胶原蛋白就会终生存在,并且随着时间的推移变得更难变性(原因在第8章中详细解释)。因此,胶原蛋白变性的速度越快,蛋白质在生物学上就越年轻。19个月大的Pit-1对照小鼠的胶原蛋白变性时间几乎是突变体的四倍。此外,虽然野生型和侏儒突变体的肿瘤(癌症)疾病发病率几乎相同,但突变体的平均出现年龄明显更大。此外,对于任何给定的年龄,侏儒突变体在生物学上都显得更年轻。虽然生命延长性能的潜在机制似乎延缓了与年龄相关的功能丧失,但这些突变为生物衰老学家提供了一种同时检测寿命(遗传)和衰老率(随机)的方法。
我们已经发现,在秀丽隐杆线虫和果蝇中观察到的胰岛素/胰岛素样生长激素信号通路与mTOR通路有密切关系。这种关系促使研究人员评估了mTOR1和mTOR2通路成分中存在单基因突变的小鼠的寿命。迄今为止,结果好坏参半。完全敲除mTOR1和mTOR2途径的各种成分中的基因被证明是胚胎致死的。然而,与野生型小鼠相比,mtor1亚型(mTORΔ/Δ)是一种基因表达功能降低的突变体,可以寿命延长。小鼠mTOR相关基因中的其他突变显示,只有一种性别的小鼠寿命增加,中值寿命增加,但最大寿命没有增加。小鼠与酵母、蠕虫和苍蝇的单基因突变在寿命调节方面的结果不一致,说明了哺乳动物中发现的基因的高度多效性和细胞途径之间的相互作用。此外,这些单基因突变未能持续延长小鼠的寿命,这支持了进化理论,也就是说,即使不是数千个基因,也必须有数百个基因参与控制衰老和寿命。
小鼠寿命的遗传调节对人类衰老有影响
具有抑制生长激素/胰岛素样信号通路的基因操纵小鼠的寿命增加是重要的,因为这表明了长寿的系统发育保守机制。这种结论的一致性加强了基于进化的预测,即长寿是为生存到生殖年龄而选择的基因的副产品。老鼠的数据也证实了另外一些对衰老生物学和人类衰老研究很重要的发现。例如,单个基因的突变会影响哺乳动物的寿命。尽管突变如何延长寿命的机制细节仍有待阐明,但人类衰老的速度显然可以在基因水平上进行评估。在未来的几年里,研究很可能会确定针对特定基因调控途径的药物,并有可能改变人类衰老的速度。
老鼠的数据还证实,寿命的增加反映了神经内分泌调节,这一发现对人类有重大影响。人类作为一个物种的成功在一定程度上反映了我们在几乎所有环境中生存和繁衍的能力。在恶劣和有时有压力的条件下生存的能力是一个高度整合的神经通路系统的结果,该系统能够识别环境线索,从而诱导维持体内平衡的激素分泌,即神经内分泌系统。例如,当孩子吃饭时,营养物质被吸收到血液中;营养物质浓度的增加告知大脑,组织已经准备如何代谢;大脑通知其他组织分泌激素,诱导有丝分裂和组织增殖,即生长。你已经看到了这一途径的中断是如何改变衰老和寿命的。很有可能其他神经内分泌系统也会产生类似的影响。
关于长寿的遗传调控的最后一点:尽管高度保守的生长激素/胰岛素样信号通路是本章的主要焦点,但它并不是延长长寿的唯一途径。它在真核生物中的描述,从简单到复杂,反映了良好的科学程序在生物衰老学遗传学研究中的应用。其他保守的途径当然与长寿有关。为了发现这些途径,研究必须以与识别生长激素/胰岛素样信号通路完全相同的方式完成。也就是说,首先要筛选寿命较短的物种中寿命较长的突变体,然后构建出寿命较长的哺乳动物的系统发育树。


