第二节 细胞及其组分的分析方法
形态学观察与细胞组分分析相结合是当代细胞生物学研究中常常采用的实验方法。它为揭示生物大分子在细胞内的空间定位、相互关系及其功能的研究提供了有力的工具。
一、用超离心技术分离细胞组分
用低渗匀浆、超声破碎或硏磨等方法可使细胞质膜破损,形成细胞核、线粒体、叶绿体、内质网、高尔基体、溶酶体等细胞器和细胞组分组成的混合匀浆,再通过差速离心,即利用不同的离心速度所产生的不同离心力,将各种质量和密度不同的亚细胞组分和各种颗粒分开(图2-22)。
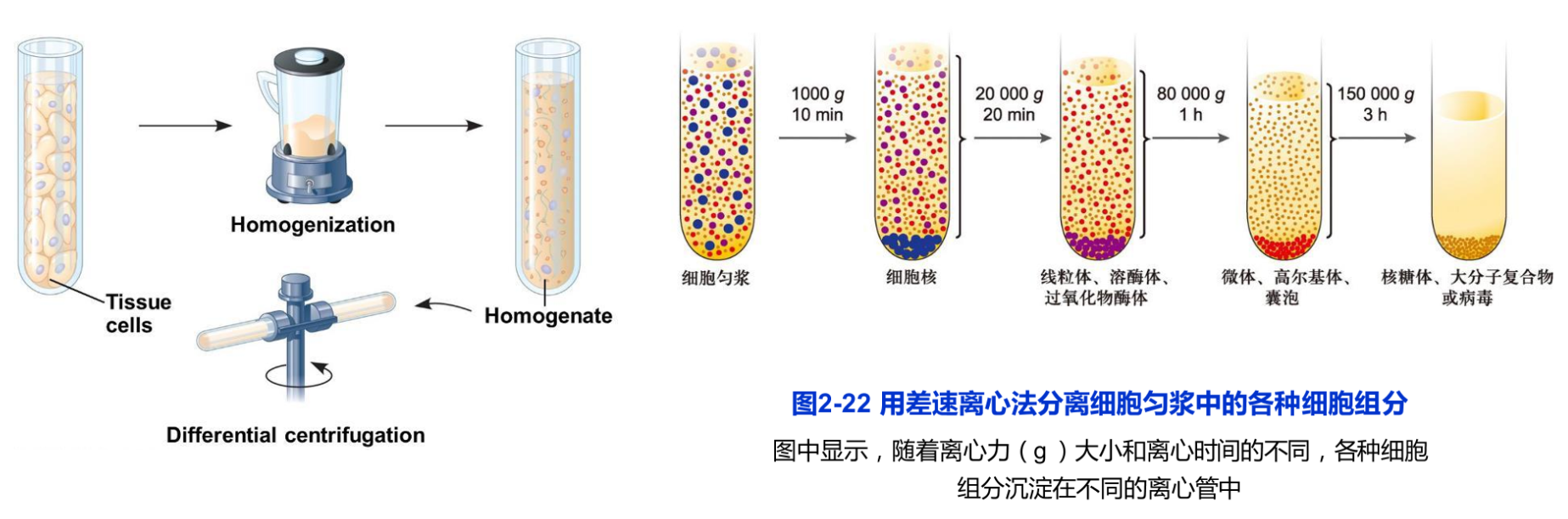
密度梯度离心是将要分离的细胞组分小心地铺放在含有密度逐渐增加的、高溶解性的惰性物质(如蔗糖)形成的密度梯度溶液表面,通过重力或离心力的作用使样品中不同组分以不同的沉降率沉降,形成不同的沉降带。各组分的沉降率与它们的形状和大小有关,通常以沉降系数(S值)表示。超速离心机可达转数105r/min,产生60万倍重力场。在这巨大离心力的作用下,甚至相当小的tRNA(沉降系数4s)和单一的酶都可根据其沉降系数相互分离开。密度梯度离心又可分为速度沉降和等密度沉降两种。常用的介质有蔗糖和氯化铯等。
速度沉降主要是用于分离密度相近而大小不一的细胞组分。离心前,将要分离的细胞匀浆物放置在蔗糖浓度梯度(通常质量分数范围为5%-40%)溶液的上层,各种细胞组分根据它们的大小以不同的速度沉降,形成不同的沉降带(图2-23),然后分别收集不同的沉降带中的组分,用于分析。
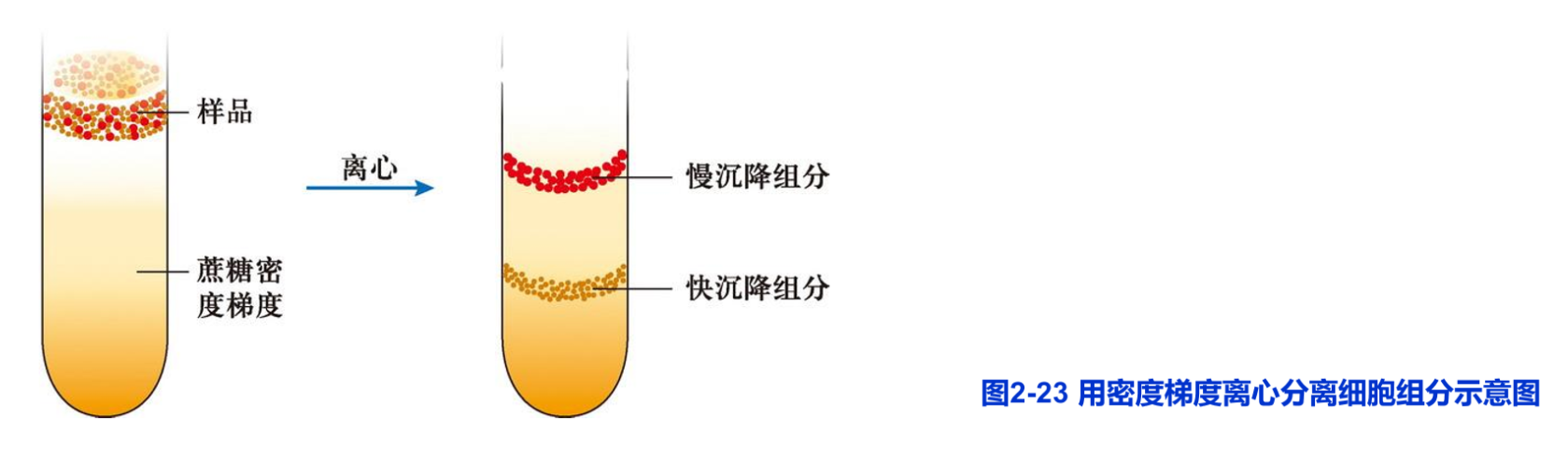
等密度沉降用于分离不同密度的细胞组分。细胞组分在连续梯度的高密度介质中经离心力场长时间的作用沉降或漂浮到与自身密度相等的位置,形成不同的密度区带。这种方法非常灵敏,甚至可以将掺入重同位素如14C或15N的生物大分子和未标记物分开。1957年,Meselson和F. Stahl利用15N标记大肠杆菌DNA,并用氯化铯等密度沉降法直接证明了DNA的半保留复制。
二、特异蛋白抗原的定位与定性
20世纪70年代以来,免疫学的迅速发展为细胞生物学的研究提供了强有力的手段,特别是在细胞内特异蛋白的定位与定性方面,单克隆抗体与其他一些检测手段相结合发挥了重要作用。免疫荧光与免疫电镜是最常见的研究细胞内蛋白质分子定位的重要技术,而对蛋白质组分进行体外分析定性通常则采用免疫印迹(Western blotting)、放射免疫沉淀(radioimmuno-precipitation)和蛋白质芯片、质谱分析等技术,这里不再一一介绍。
(一)免疫荧光技术
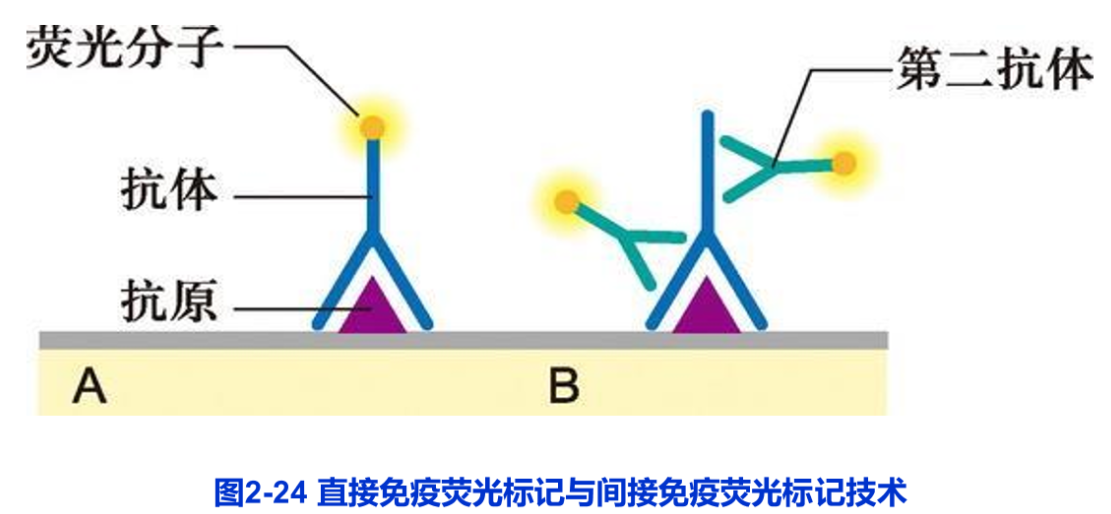
前面已经介绍了荧光显微镜技术,其中也提到免疫荧光技术。所谓免疫荧光技术就是将免疫学方法(抗原一抗体特异结合)与荧光标记技术相结合用于研究特异蛋白抗原在细胞内分布的方法,它包括直接和间接免疫荧光技术两种(图2-24)。实验步骤主要包括荧光抗体的制备、标本的处理、免疫染色和观察记录等过程。标本处理有多种方法,组织切片、冷冻切片、整装细胞都可应用,其宗旨只有一个,即要尽量完好地保持被检测蛋白质的抗原性;免疫染色就是抗原一抗体反应的过程,这里要注意设立各种实验对照以保证结果的可靠性。除免疫荧光技术外,还可用免疫酶标记技术,即以酶(如辣根过氧化物酶)代替荧光素与抗体偶联,因此可在普通显微镜下观察。近年来,激光扫描共焦显微镜的应用使免疫荧光技术在细胞生物学研究中发挥了越来越大的作用。
(二)免疫电镜技术
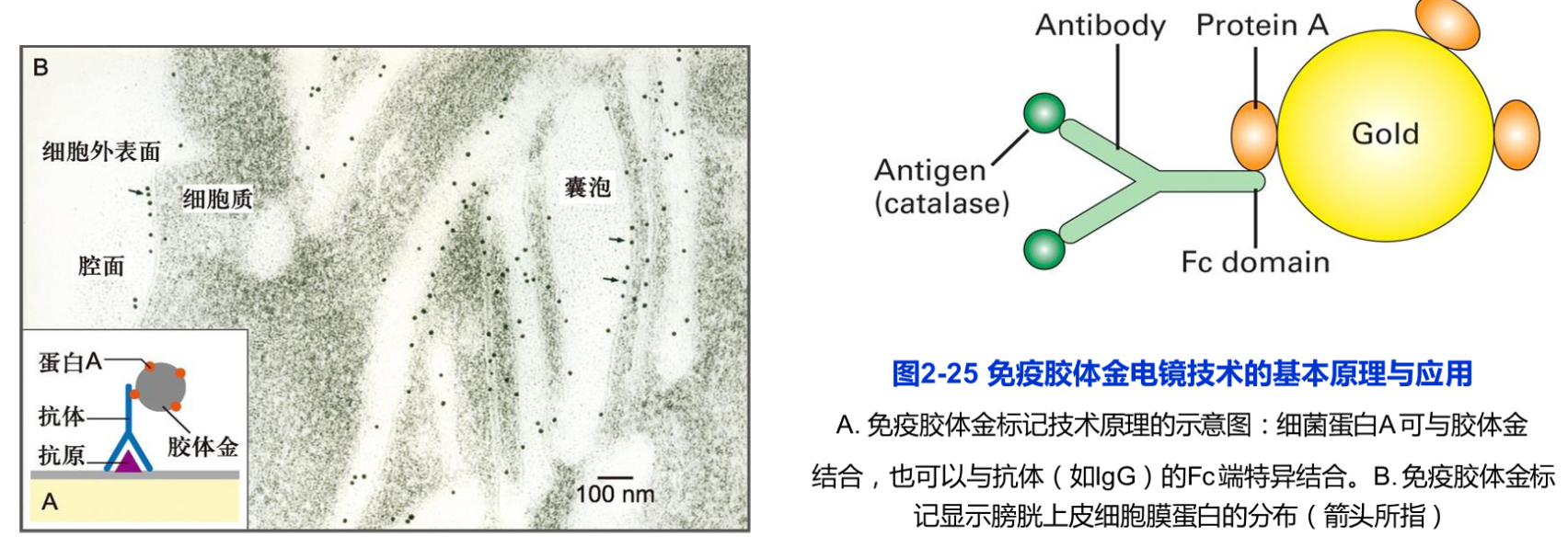
免疫荧光技术快速、灵敏、特异性强,但其分辨率有限。免疫电镜技术则能有效地提高样品的分辨率,在超微结构水平上研究特异蛋白抗原的定位免疫电镜技术可分为免疫铁蛋白技术、免疫酶标技术与免疫胶体金技术,其主要区别是与抗体结合的标志物不同,这在一定程度上也反映了免疫电镜技术的发展过程。目前,免疫铁蛋白技术几乎已无人问津,而免疫胶体金技术则受到越来越多的青睐。胶体金本身具有许多优点,如:在电镜下金颗粒容易识别,并可以制成5nm、10nm或20nm等不同直径的金颗粒,用以双重标记或多重标记。
免疫电镜技术的样品制备程序与免疫荧光技术类似(图2-25),包括样品的固定、包埋、超薄切片制备、免疫标记和染色等步骤。其技术关键是在样品制备过程中既要保持样品中蛋白的抗原性,又要尽量保存样品的精细结构。免疫电镜技术至今已得到广泛应用。
三、细胞内特异核酸的定位与定性
细胞内特异核酸(DNA或RNA)的定性与定位的研究,通常采用原位杂交(in situ hybridization)技术。用标记的核酸探针通过分子杂交确定特异核苷酸序列在染色体上或在细胞中的位置的方法称为原位杂交。
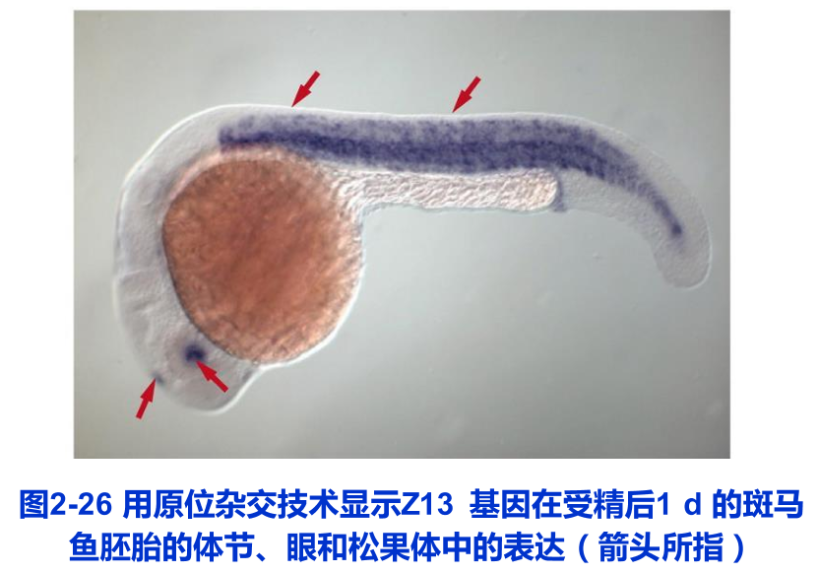
原位杂交技术首先是在光镜水平上发展起来的,放射性同位素标记的探针与样品中的DNA或RNA杂交后,用显微放射自显影的方法显示杂交物的存在部位; 或用荧光素标记的探针进行杂交,在荧光显微镜下直接显示细胞中与探针杂交的特异核酸。近年来,以生物素等生物小分子代替同位素或荧光素标记探针,使原位杂交技术得到了更为广泛的应用发展。电镜原位杂交技术可将特异序列核苷酸的定位与细胞的超微结构结合起来,其基本原理与光镜原位杂交类似,只是探针标记物不同,杂交反应的检测常常是通过与抗生物素抗体相连的胶体金颗粒显示出来的原位杂交技术在显微与亚显微水平上研究基因定位特异mRNA表达等问题的研究中具有重要作用(图2-26)。
四、细胞成分的分析与细胞分选技术
流式细胞术(flow cytometry)可定量地测定某一细胞中的DNA、RNA或某一特异的标记蛋白的含量,以及细胞群体中上述成分含量不同的细胞的数量,它还可将某一特异染色的细胞从数以万计的细胞群体中分离出来,以及将DNA含量不同的中期染色体分离出来,甚至可用于细胞的分选。
细胞群体一般需要分散后对待测的某种成分进行特异的荧光染色,然后使悬液中的细胞一个个快速通过流式细胞仪(每秒可达几万个细胞)。当含有单个细胞的液滴通过激光束时,带有不同荧光的细胞所在的液滴被充上正电荷、负电荷,或不被充电,同时检测器可测出并记录每个细胞中的待测成分的含量。因带有不同表面标志的细胞所带的电荷的种类不同,当液滴通过高压偏转板时,带不同电荷的液滴发生偏转,从而达到将细胞分选的目的(图2-27)。如果染色过程不影响细胞活性,那么分离出来的细胞还可以继续培养。



